
| 方案 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |  |
| ① | 浓硝酸 | Na2S | AgCl溶液 | NaOH溶液 | |
| ② | 浓醋酸 | CaCO3 | NaOH溶液(过量) | Na2SiO3溶液 | |
| ③ | 浓盐酸 | KMnO4 | NaBr溶液 | KI溶液 | |
| ④ | 浓硫酸 | 蔗糖 | KMnO4溶液(过量) | 石灰水 |
| A. | 用①来验证溶解度:S(Ag2S)<S(AgCl) | |
| B. | 用②来验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| C. | 用③来验证氧化性:KMnO4>Cl2>Br2>I2 | |
| D. | 用④来验证蔗糖与浓硫酸作用后有SO2和CO2产生 |
分析 A.若发生沉淀的转化,可知Ksp大小,但沉淀类型不同;
B.醋酸挥发,醋酸与二氧化碳均被NaOH吸收,不能发生二氧化碳与硅酸钠的反应;
C.浓盐酸与高锰酸钾反应生成氯气,氯气可氧化NaBr、KI;
D.浓硫酸具有脱水性,蔗糖碳化后,C与浓硫酸反应生成气体,高锰酸钾褪色可检验二氧化硫,石灰水变浑浊可检验二氧化碳.
解答 解:A.Ⅲ中观察到白色变为黑色,可知发生沉淀的转化,可知Ksp大小,但沉淀类型不同,则不能比较S(Ag2S)、S(AgCl),故A错误;
B.醋酸挥发,醋酸与二氧化碳均被NaOH吸收,不能发生二氧化碳与硅酸钠的反应,则不能比较酸性,故B错误;
C.浓盐酸与高锰酸钾反应生成氯气,氯气可氧化NaBr、KI,则不能比较Br2、I2的氧化性,故C错误;
D.浓硫酸具有脱水性,蔗糖碳化后,C与浓硫酸反应生成气体,高锰酸钾褪色可检验二氧化硫,石灰水变浑浊可检验二氧化碳,则④可验证蔗糖与浓硫酸作用后有SO2和CO2产生,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握沉淀的转化、酸性比较、氧化性比较、实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
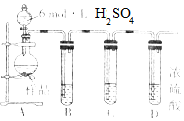 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L苯中含有NA个苯分子 | |
| B. | 14g N2含有的核外电子总数为14NA | |
| C. | 1 mol乙炔分子含3NA个碳碳叁键 | |
| D. | 23g金属钠与足量水反应时失去的电子数是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| B. | 稀H2SO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═2C6H5OH+SO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+═CH3COOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
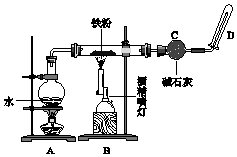 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
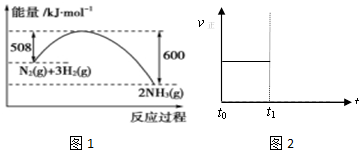
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | 16O与18O互为同位素 | ||
| C. | 氯离子的结构示意图: | D. | NaClO的电子式: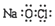 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com