
)磷酸燃料电池是目前较为成熟的燃料电池,其基本组成和反应原理如下。
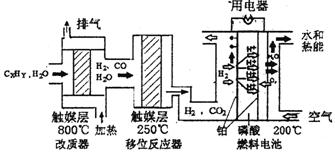
(1)在改质器中主要发生的反应为_______________________________
(2)移位反应器中CO(g)+H2O (g) 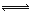 CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
CO2 (g)+H2(g) ,在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
①此温度下,该反应的平衡常数为________
②反应在3~4 min之间,氢气的物质的量增多的原因可能是 (填代号)
A.充入水蒸汽 B.升高温度 C.使用催化剂 D.充入氢气
(3)磷酸燃料电池负极排出的气体主要是___ __,
该电池正极的电极反应为_ _ __。
(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是 。
(5)总体看来,整个体系中能量来自与CxHy与空气的反应,假设CxHy为辛烷,且
已知辛烷的燃烧热为5 518 kJ·mol-1,请写出辛烷燃烧热的热化学方程式 。
【知识点】燃料电池原理 化学平衡的移动 热化学方程式 F1 F3 G2
【答案解析】(1)CxHy+XH2O 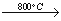 XCO+(X+Y/2)H2
XCO+(X+Y/2)H2
(2)① 0.5② B
(3) CO2 O2 +4H++4e--=2H2O
(4) 增大电极单位面积吸附H2、O2分子数,加快反应速率
(5) C8H18(l)+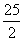 O2(g)===8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1
解析:(1)改质器中进入的物质是烃和水,反应温度是800℃,出来的气体是水、氢气和一氧化碳,所以发生的化学反应:CxHy+XH2O 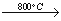 XCO+(X+Y/2)H2(2)①根据氢气浓度增加了0.1mol/L, n1、n2、n3分别为0.1mol/L、0.2mol/L、0.1mol/L,k=
XCO+(X+Y/2)H2(2)①根据氢气浓度增加了0.1mol/L, n1、n2、n3分别为0.1mol/L、0.2mol/L、0.1mol/L,k=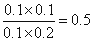 ;② 反应物的浓度都减小了0.1mol/L,生成物的浓度都增大了0.1mol/L,排除ADC,选B;(3)燃料电池中,负极上燃料失去电子发生氧化反应,二氧化碳是废气,所以排出的气体是二氧化碳,正极上氧化剂得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是增大电极单位面积吸附H2、O2分子数,加快反应速率,(5)根据燃烧热的定义及热化学方程式的要求得: C8H18(l)+
;② 反应物的浓度都减小了0.1mol/L,生成物的浓度都增大了0.1mol/L,排除ADC,选B;(3)燃料电池中,负极上燃料失去电子发生氧化反应,二氧化碳是废气,所以排出的气体是二氧化碳,正极上氧化剂得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O(4)磷酸燃料电池的电极上镀了铂粉,这样做的目的,除了起到更好的导电作用外,还具备的作用是增大电极单位面积吸附H2、O2分子数,加快反应速率,(5)根据燃烧热的定义及热化学方程式的要求得: C8H18(l)+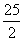 O2(g)===8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1注意辛烷为液态,放热反应的ΔH为负。
O2(g)===8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1注意辛烷为液态,放热反应的ΔH为负。
【思路点拨】本题考查了燃料电池的基本原理,难度不大,注意电极反应式的书写要结合电解质溶液的酸碱性,电解质溶液的酸碱性不同,电极反应式可能不同。注意辛烷为液态,放热反应的ΔH为负。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
分子式为C10H20O2的有机物在酸性条件下可水解为醇A和酸B,A经过连续氧化可转化为B,若不考虑立体异构,符合上述要求的醇和酸若重新组合,可形成的酯共有:( )
A.32 B.16 C.8 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:

(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性 B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450ml
l60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,
所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3) 吸收塔内的温度不能超过20℃,其主要目的是 _,吸收塔内发生反应的化学方程式为 。
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
A.蒸馏 B.蒸发浓缩 C.灼烧 D.过滤 E、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CH3OH(g)+3/2O2(g) = CO2(g) + 2H2O(g) △H = a kJ·mol- 1
CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H = b kJ·mol- 1
则下列叙述正确的是
A.C—H键键长小于H—H键
B.甲烷的燃烧热为b kJ·mol -1
C.2CH3OH(g)=2CH4(g)+O2(g) △H=2(a—b) kJ·mol- 1
D.当甲醇和甲烷物质的量之比为l:2时,其完全燃烧生成CO2和H2O(g)时,放出的热量为c kJ,则该混合物中甲醇的物质的量为c/(a+2b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
.已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
、下列说法中正确的是( )
A、煤燃烧是化学能转化为光能的过程
B、1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C、HCl 和 NaOH 反应的中和热 ΔH=-57.3 kJ·mol-1,则 H2SO4 和 Ca(OH)2 反应中和热
ΔH=2×(-57.3)kJ·mol-1
D、反应 H2(g)+F2(g)===2HF(g);ΔH=-270 kJ·mol-1说明在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是
A.3.4mol/L B.0.2mol/L C.1.8mol/L D.3.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,pH=9的NaOH溶液和CH3COONa溶液中,假设由水电离产生的OH-浓度分别为a和b,则a与b的关系为( )
A.a>b B.a=10-4b C.b=10-4a D.a=b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com