
 目前大量的照明材料或屏幕都使用了发光二极管(LED).市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
目前大量的照明材料或屏幕都使用了发光二极管(LED).市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:| 5+3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| ||
| a3 |
| 3 |
| ||
| 1 |
| 4 |
| ||
| 4 |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||


科目:高中化学 来源: 题型:
| A、大于a | B、小于a |
| C、等于a | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
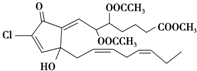 从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )
从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )| A、分子有3种含氧官能团 |
| B、分子中所有碳原子可以处于同一平面 |
| C、1mol该物质最多消耗4mol NaOH或3mol Br2 |
| D、该物质中只有一种官能团能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com