
分析 (1)发生反应:Zn+2HCl=ZnCl2+H2↑,利用双线桥表示电子转移,由反应物指向生成物,表示同种元素之间电子得失情况,并注明电子转移数目;
(2)根据方程式计算生成氢气的物质的量,再根据V=nVm计算氢气的体积;根据方程式计算n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度;
(3)通过反应方程式可求推出1molZn转移电子数,计算参加反应的Zn的物质的量进而推出反应中转移的电子数目.
解答 解:(1)发生反应Zn+2HCl=ZnCl2+H2↑,Zn从0价到+2价化合价升高2价,失去2个电子,电子转移方向和数目为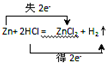 ,
,
故答案为:Zn+2HCl=ZnCl2+H2↑, ;
;
(2)Zn+2HCl=ZnCl2+H2↑
65g 2mol 1mol
6.5g n(Zn) ${n}_{({H}_{2})}$
所以$\frac{65g}{6.5g}$=$\frac{2}{n}$
解得n(Zn)=0.2mol,${n}_{({H}_{2})}$=0.1mol
${V}_{({H}_{2})}$=0.1mol×22.4mol/L=2.24L
C(HCl)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:生成气体2.24L,盐酸的物质的量浓度为1mol/L;
(3)6.50g锌的物质的量为:$\frac{6.5g}{65g/mol}$=0.1mol
由化学方程式Zn+2HCl=ZnCl2+H2↑
1molZn转移2mol电子,0.1molZn转移0.2mol电子,N(电子)=0.2mol×6.02×1023mol-1=1.204×1022,
故答案为:1.204×1022.
点评 本题考查根据方程式的计算、常用化学计量的有关计算,比较基础,注意基础知识的掌握与根据方程式计算的格式.


 全优考典单元检测卷及归类总复习系列答案
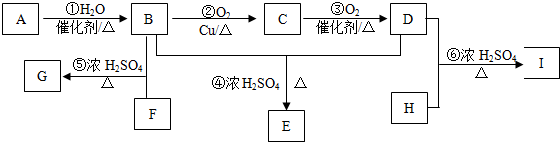
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
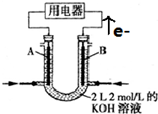
科目:高中化学 来源: 题型:选择题

| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电流从锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、乙醇、乙醛 | B. | 乙炔、乙醛、乙二醇 | ||
| C. | 甲醇、甲醚、甲醛 | D. | 乙烷、甘油、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
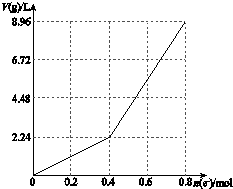 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2 mol/L | |
| B. | 电解后所得溶液中c(H+)=1 mol/L | |
| C. | 当n(e-)=0.6 mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com