
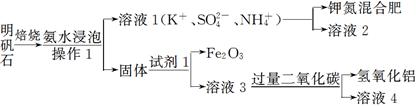


科目:高中化学 来源:不详 题型:实验题
| | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量) 2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
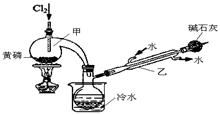
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| B.用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| D.测定中和反应反的应热时,将碱液缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
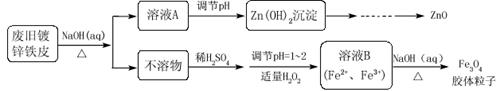
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.③⑤⑥ | C.①②④ | D.③④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验做完后,直接用嘴吹灭酒精灯 |
| B.浓硫酸沾到皮肤上时,立即用湿抹布冲洗,然后涂上3%~5%的NaOH溶液 |
| C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
| B.制取并用排水法收集氧气结束后,应立即停止加热 |
| C.浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| D.浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com