
| A. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
分析 A.电极为铜,则阳极铜放电生成铜离子,阴极氢离子得到电子生成氢气;
B.铁粉过量,反应生成亚铁离子;
C.硫酸铝铵与氢氧化钡的物质的量之比为 1:2,反应生成硫酸钡、氢氧化铝沉淀和一水合氨;
D.氢氧化钡少量,反应生成碳酸钡沉淀、碳酸钠和水.
解答 解:A.用铜电极电解饱和食盐水,阳极铜放电,正确的离子方程式为:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2+H2↑,故A错误;
B.浓硝酸溶液中加入过量铁粉并加热,反应生成硝酸亚铁、二氧化氮气体和水,正确的离子方程式为:Fe+2NO3-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe2++2NO2↑+2H2O,故B错误;
C.溶液中NH4Al(SO4)2 与Ba(OH)2 以物质的量之比1:2,反应生成氢氧化铝、硫酸钡沉淀和一水合氨,正确的离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+2BaSO4↓+NH3•H2O,故C正确;
D.小苏打溶液中加少量Ba(OH)2溶液,反应生成碳酸钡沉淀和碳酸钠,正确的离子方程式为:HCO3-+Ba2++2OH-═CO32-+BaCO3↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写,为高考的高频题,题目难度中等,注意掌握离子方程式的书写方法,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属单质都有还原性 | |
| B. | 镁、铝虽然还原性较强,但可以直接置于空气中保存,是因为表面能形成致密的氧化膜,保护了内层的金属 | |
| C. | 铝箔在酒精灯上加热后熔化但不滴落,是因为表面形成的Al2O3层熔点很高 | |
| D. | 钠和镁可以剧烈地燃烧,铝和铁则不能燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
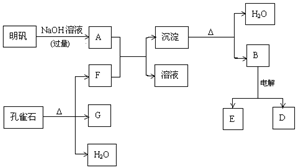
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 3:4 | C. | 2:1 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有腐蚀性的药品必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| B. | 使用容量瓶前,在容量瓶中加适量水,用食指摁住瓶塞倒立,如不漏水,即可使用 | |
| C. | 混合浓硫酸和乙醇时,将浓硫酸慢慢加入乙醇试管中并及时搅拌 | |
| D. | 油或酒精着火时都可以用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
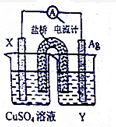 I、依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
I、依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比苯酚溶液大 | B. | 比苯酚溶液小 | ||
| C. | 与苯酚溶液相等 | D. | 无法和苯酚溶液比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com