
【题目】氮及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2)是人类最早合成的有机物,工业上生产尿素的反应为: N2+3H2![]() 2NH3,2NH3+CO2
2NH3,2NH3+CO2![]() H2NCONH2+H2O。回答下列问题:
H2NCONH2+H2O。回答下列问题:
(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为______,Zn位于元素周期表的_______区。
(2)C、N、O三种元素第一电离能从大到小的顺序是___________。
(3)上述化学方程式中的无机化合物,沸点由高到低的顺序是____________,原因: ___________。
(4)尿素分子中,原子杂化轨道类型有____________,σ键与π键数目之比为_______。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表亓晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(![]() ),则E原子的坐标参数为_____。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N与B的原子半径之和为______pm。(
),则E原子的坐标参数为_____。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N与B的原子半径之和为______pm。(![]() )
)
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的计算表达式为_______pm。
【答案】 ![]() ds N>O>C H2O>NH3>CO2 三者都是分子晶体,但H2O和NH3都存在分子间氢键,且H2O分子间的氢键作用力强于NH3 sp2、sp3 7∶1 (
ds N>O>C H2O>NH3>CO2 三者都是分子晶体,但H2O和NH3都存在分子间氢键,且H2O分子间的氢键作用力强于NH3 sp2、sp3 7∶1 (![]() ,
, ![]() ,
,![]() ) 156.5
) 156.5 ![]() ×1010
×1010
【解析】本题主要考查物质结构。
(1)Cu2+价层电子的轨道表达式为![]() ,Zn位于元素周期表的ds区。
,Zn位于元素周期表的ds区。
(2) 一般非金属性越强,第一电离能越大,非金属性:C<N<O,而且由于氮原子最外层电子处于半充满的较稳定状态,使得氮的第一电离能大于氧,所以C、N、O三种元素第一电离能从大到小的顺序是N>O>C。
(3)上述化学方程式中的无机化合物,沸点由高到低的顺序是H2O>NH3>CO2,原因: 三者都是分子晶体,但H2O和NH3都存在分子间氢键,且H2O分子间的氢键作用力强于NH3。
(4)尿素分子中,C原子杂化轨道类型是sp2,N原子杂化轨道类型是sp3,σ键与π键数目之比为7:1。
(5)①E原子的坐标参数为(![]() ,
, ![]() ,
,![]() )。设立方氮化硼晶体N与B的原子半径之和为x,晶胞体对角线为4x,4x=361.5
)。设立方氮化硼晶体N与B的原子半径之和为x,晶胞体对角线为4x,4x=361.5![]() pm,x=156.5pm,则立方氮化硼晶体N与B的原子半径之和为156.5pm。
pm,x=156.5pm,则立方氮化硼晶体N与B的原子半径之和为156.5pm。
②每个六棱柱平均含有一个N原子和一个B原子,两原子的相对原子质量之和为25,设层与层之间距离为h,六棱柱体积为![]() a2hcm3,六棱柱质量为25g/NA=
a2hcm3,六棱柱质量为25g/NA=![]() a2hdg,h=
a2hdg,h=![]() ×1010pm,则层与层之间距离的计算表达式为
×1010pm,则层与层之间距离的计算表达式为![]() ×1010pm。
×1010pm。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是化合反应的是( )
A.灼热的碳与二氧化碳反应B.铝片与稀硫酸的反应
C.甲烷在氧气中的燃烧D.Ca(OH)2溶液与足量CO2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中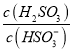 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀pH | 沉淀完全pH | 物质 | 20℃溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-6 |
(1)将粉碎的含镍废料酸浸时要不断搅拌,粉碎和搅拌的目的是________________。
(2)调节pH步骤中,溶液pH的调节范围是__________________________________。
(3)滤渣1和滤渣3主要成分的化学式分别是________________,_____________。
(4)氧化步骤中加入H2O2发生反应的离子方程式为____________________________。
(5)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。该反应的化学方程式为____________________。
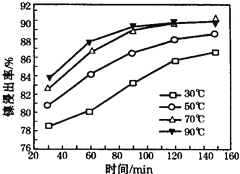
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm之间的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀地分散入蒸馏水中,得到的物质()
①是溶液 ②是胶体 ③具有丁达尔效应 ④能透过滤纸 ⑤静置会立即形成沉淀
A.②③④B.②③⑤C.①④⑤D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com