
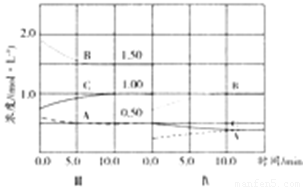
反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
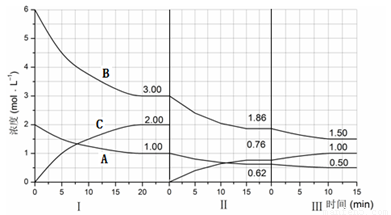
回答问题:
(1)反应的化学方程式中,a:b:c为 ;
(2)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是 ,其值是 ;
(3)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3 (填“<”、“>或“=”),判断的理由是 ;
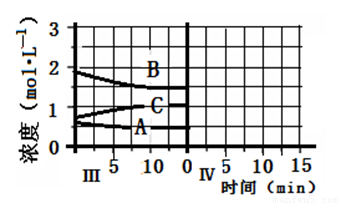
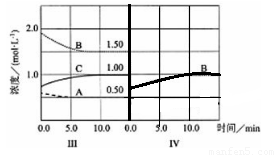
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中B物质的浓度随时间变化的趋势(注:只须画出B的浓度随时间变化曲线)。
(1)1∶3∶2(2分)
(2)αⅠ(B)(2分) 50%(2分)
(3)向正反应方向(2分) 从反应体系中移出产物C(2分)
(4)>(2分) 此反应为放热反应,降低温度,平衡向正反应方向移动(或降低温度,反应速率减慢)(2分)
(5)(2分)
【解析】
试题分析:(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol·L-1-1mol·L-1=1mol·L-1,△c(B)=6mol·L-1-3mol·L-1=3mol·L-1,△c(C)=2mol·L-1,浓度变化量之比等于化学计量数之比,故a:b:c=1mol·L-1:3mol·L-1:2mol·L-1=1:3:2,答案为:1:3:2;
⑵B的平衡转化率αⅠ(B)=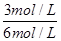 ×100%=50%,αⅡ(B)=
×100%=50%,αⅡ(B)=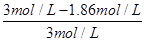 ×100%=38%,αⅢ(B)=
×100%=38%,αⅢ(B)=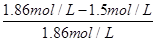 ×100%=19.4%,答案为:αⅠ(B);50%;
×100%=19.4%,答案为:αⅠ(B);50%;
⑶第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动,答案为:平衡正向移动;从反应体系中移出产物C;
⑷第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低,答案为:>;此反应为放热反应,降低温度,平衡向正反应方向移动。
⑸将容器的体积扩大一倍后,容器内压强减小,平衡向逆反应方向移动,A和B的物质的量增大,C的物质的量减小,但容器体积增大,则A、B、C的浓度都减小,
考点:反应速率的定量表示方法;化学平衡的计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | c(A)/mol L-1 | c(B)/mol L-1 | c(C)/mol L-1 |
| 0min | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.4 |
| 第4min | 0.4 | 1.8 | 1.2 |
| 第6min | 0.4 | 1.8 | 1.2 |
| 第8min | 0.1 | 2.0 | 1.8 |
| 第9min | 0.05 | 1.9 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) | c(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动 | B、a>(b+c) | C、物质B的质量分数增大 | D、以上判断都错误 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com