
| A. | 该反应既是置换反应又是氧化还原反应 | |
| B. | Zn作还原剂,H2SO4作氧化剂 | |
| C. | Zn被氧化,H2SO4被还原 | |
| D. | 发生氧化反应的物质是H2SO4,发生还原反应的物质是Zn |
分析 Zn+H2SO4=ZnSO4+H2↑,Zn化合价升高作还原剂被氧化,发生氧化反应,硫酸中氢化合价降低为氧化剂被还原,发生还原反应,据此分析.
解答 解:A、Zn+H2SO4=ZnSO4+H2↑Zn化合价升高作还原剂,硫酸中氢化合价降低为氧化剂,为氧化还原反应,又单质与化合物反应生成单质与化合物,所以又是置换反应,故A正确;
B、Zn化合价升高作还原剂被氧化,发生氧化反应,硫酸中氢化合价降低为氧化剂,故B正确;
C、Zn化合价升高作还原剂被氧化,发生氧化反应,硫酸中氢化合价降低为氧化剂被还原,发生还原反应,故C正确;
D、Zn化合价升高作还原剂被氧化,发生氧化反应,硫酸中氢化合价降低为氧化剂被还原,发生还原反应,故D错误;
故选D.
点评 本题考查氧化还原反应的基本概念的分析,明确化合价变化是解本题的关键,难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 混合气体的颜色不再变化 | |
| B. | NO、O2、NO2的分子个数之比为2:1:2 | |
| C. | 反应混合物中各组分的物质的量浓度相等 | |
| D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2011年深圳大运会“虹”火炬采用丙烷为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
2011年深圳大运会“虹”火炬采用丙烷为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
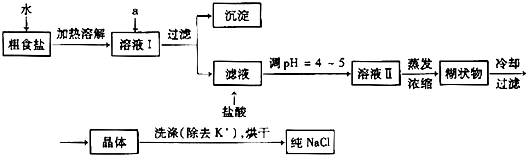
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com