
| A. | NaF | B. | NaCl | C. | SO2 | D. | CaCl2 |
分析 电子层数越多,离子半径越大,同一主族,离子半径随着原子序数增大而增大,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:含有离子键的化合物是离子化合物,A、B、D是离子化合物,C是共价化合物,
电子层数越多,离子半径越大,同一主族,离子半径随着原子序数增大而增大,阴离子比较大小顺序是Cl->F-,阳离子比较大小顺序是Ca2+>Na+,所以阴阳离子半径之和最大的离子化合物是氯化钙,
故选D.
点评 本题考查离子化合物判断及离子半径大小比较,为高频考点,明确物质构成微粒及微粒之间作用力、离子半径大小比较方法即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
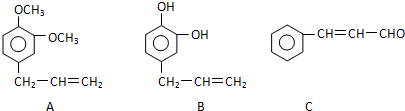
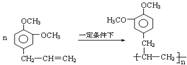
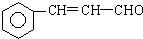 +5H2$\stackrel{一定条件下}{→}$
+5H2$\stackrel{一定条件下}{→}$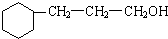 .
.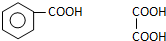 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,OH-向正极移动 | |
| B. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 工作一段时间后,电解质溶液的PH变大 | |
| D. | 用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mole-转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
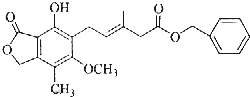
| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1mol该化合物最多可以与4molNaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com