
| A. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| B. | 将25 g CuSO4•5H2O溶于100 mL蒸馏水配制100 mL 1.0 mol•L-1 CuSO4溶液 | |
| C. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
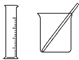
| D. | 配制100 mL 0.100 0 mol•L-1 K2Cr2O7溶液所选择的装置或仪器(夹持装置已略去)是 |
分析 A.定容时俯视刻度线,加入蒸馏水体积偏小,配制溶液浓度偏大;
B.硫酸铜溶于100mL溶液中,所得溶液体积不是100mL;
C.若加水超过容量瓶刻度,所得溶液体积偏大,配制溶液浓度偏小,应该重新配制;
D.配制100mL溶液,必须使用100mL容量瓶和胶头滴管.
解答 解:A.用容量瓶配制溶液,定容时俯视刻度线,加入蒸馏水在刻度线下方,导致溶液体积偏小,所配溶液浓度偏大,故A正确;
B.将25 g CuSO4•5H2O溶于100 mL蒸馏水,所得溶液体积不是100mL,所得溶液不是100mL 1.0 mol•L-1 CuSO4溶液,故B错误;
C.配制溶液时,若加水超过容量瓶刻度,配制的溶液体积偏大,应该重新配制,不能用胶头滴管将多余溶液吸出,故C错误;
D.配制100 mL 0.100 0 mol•L-1 K2Cr2O7溶液所选择的装置或仪器有玻璃杯、烧杯、胶头滴管和100mL容量瓶,还缺少胶头滴管和容量瓶,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度中等,侧重考查配制一定物质的量浓度溶液的方法,明确配制步骤为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、K+、SO42-、Br- | B. | K+、Na+、AlO2-、Cl- | ||
| C. | Fe3+、K+、SO42-、NO3- | D. | K+、Na+、NO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用激光笔分别照射蛋白质溶液、硅酸溶胶 | 将二者区别开 |
| B | 将C2H5OH与浓H2SO4在蒸馏烧瓶中混合后加热至 170℃,烧瓶内逸出的物质通入到酸性KMnO4溶液中 | 检验有无乙烯生成 |
| C | 将Al(OH)3置于适量0.2mol•L-1 FeCl3溶液中,-段时间后可得到红褐色固体 | 溶度积:Ksp[AL(OH)3]>Ksp[Fe(OH)3] |
| D | 向蔗糖溶液中加入适量稀硫酸,水浴加热几分钟,然后加入新制的银氨溶液,并水浴加热 | 检验蔗糖的水解产物是否具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质是由一种元素组成的物质,则由一种元素组成的物质一定是单质 | |
| B. | 氧元素与硫元素原子的最外层电子数相同,所以二者具有相似的化学性质 | |
| C. | 溶液中有晶体析出,其溶质质量减小,所以溶质的质量分数一定减小 | |
| D. | 碱溶液能使酚酞试液变红,滴入酚酞试液后变红的一定是碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 2:7 | C. | 2:5 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
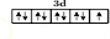 ;
;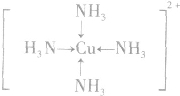 ;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度℃ | 10 | 30 | 60 | 90 |
| 浓度(mol/L) | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com