
| A. | 1个氖原子 Na | B. | +2价的铁元素 Fe+2 | ||
| C. | 4个氢分子 4H | D. | 3个硝酸根离子 3NO3- |
分析 A.Na为钠原子,氖原子为Ne;
B.亚铁离子所带电荷的表示方法不合理;
C.H为氢原子,氢气的分子式为H2;
D.硝酸根离子为NO3-,用离子前面数字表示离子数.
解答 解:A.Na为金属钠原子,1个氖原子正确的表示方法为Ne,故A错误;
B.+2价的铁元素为亚铁离子,正确的表示方法为:Fe2+,故B错误;
C.4H表示4个H原子,4个氢气分子应该表示为:H2,故C错误;
D.硝酸根离子为NO3-,3个硝酸根离子可以表示为3NO3-,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及原子、离子、分子的表示方法,明确常见化学用语的表示方法为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | 含Y元素的盐溶液一定显酸性 | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | X、W分别形成的简单气态氢化物可反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
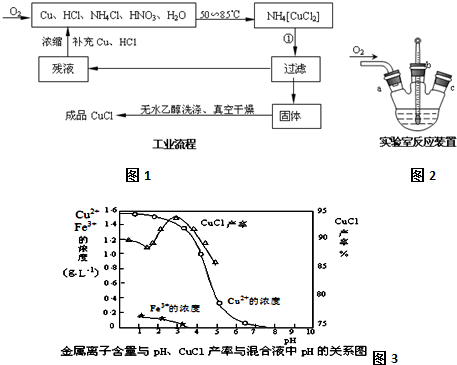
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
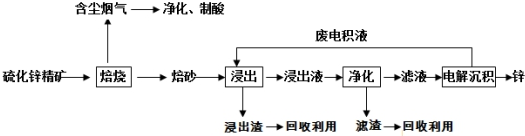
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等. D.相同压强时,NH3沸点比PH3高
D.相同压强时,NH3沸点比PH3高查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化学变化中一定发生物理变化 | |
| B. | 蓄电池充电时,电能转变成化学能 | |
| C. | 人类利用的能量都是通过化学反应获得的 | |
| D. | 有颜色改变的变化一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com