
| A. | 以苯为萃取剂萃取溴水中的溴,分液时应从下口放出苯溶液 | |
| B. | 蒸馏过程时,加热一段时间后,忘加沸石,应停止加热立刻补加 | |
| C. | 分离I2和铁粉的混合物,可加热,利用I2易升华的特性分离 | |
| D. | 配置1mol/L的盐酸,定容后摇匀,液面下降,不影响准确性 |
科目:高中化学 来源: 题型:选择题
| A. | 加热时,二者均能稳定存在 | B. | 两者均有丁达尔效应 | ||
| C. | 加入盐酸先沉淀,后溶解 | D. | 分散质微粒可通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | SiO2 | MgCl2 | CaCl2 | SiCl4 |
| 熔点(℃) | 1723 | 712 | 782 | -68 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 只含共价键的物质一定是共价化合物 | |
| C. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
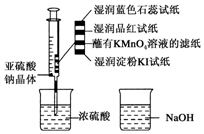 二氧化硫能起漂白、保鲜作用,使物品颜色显得白亮、鲜艳.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).下列有关说法正确的是( )
二氧化硫能起漂白、保鲜作用,使物品颜色显得白亮、鲜艳.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).下列有关说法正确的是( )| A. | 蓝色石蕊试纸变红后褪色 | |
| B. | NaOH溶液可用于除去实验中多余的SO2 | |
| C. | 湿润淀粉KI试纸未变蓝,说明SO2有还原性 | |
| D. | 品红试纸、蘸有KMnO4溶液的滤纸均褪色,证明了SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及预期现象 | 结论 | |
| A | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 向某无色溶液滴加硝酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | A1箔插入稀HNO3中,无现象 | A1箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
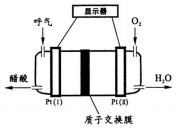
| A. | 该检测仪利用了电解原理 | |
| B. | 质子交换膜具有类似盐桥的平衡电荷作用 | |
| C. | Pt(l)极反应为:CH3CH2OH-4e-+H2O=4H++CH3COOH | |
| D. | 工作中电子由Pt(l)电极经过质子交换膜流向Pt(II) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
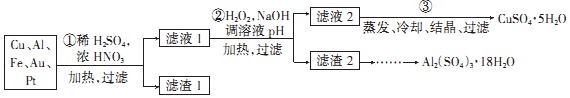

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com