
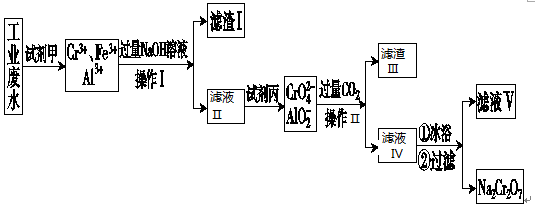
分析 工业废水中含有Cr3+,同时还含有少量的Fe2+、Fe3+和Al3+等,且酸性较强,根据流程图知,工业废水中加入试剂甲后溶液中没有Fe2+,说明废水中的Fe2+被氧化生成Fe3+,甲应该具有强氧化性,且不能引进杂质,则试剂甲为双氧水;向溶液中加入过量NaOH溶液,Fe3+转化为氢氧化物沉淀,根据题给信息可知,Al3+、Cr3+和过量NaOH反应生成可溶性的钠盐,然后采用过滤方法得到滤渣I、滤液I,滤渣I为Fe(OH)3,滤液Ⅱ中含有NaAlO2、NaCrO2、NaOH,加入试剂病生成CrO42-,丙应具有氧化性,应为氯气,然后在滤液中通过过量的二氧化碳,可生成滤渣Ⅲ为Al(OH)3,滤液Ⅳ经冰浴、过滤得到Na2Cr2O7,以此解答该题.
解答 解:(1)由以上分析可知操作I用于分离固体和液体,为过滤操作,甲应该具有强氧化性,将Fe2+氧化成Fe3+,滤渣Ⅰ的主要成分为Fe(OH)3,
故答案为:过滤;将Fe2+氧化成Fe3+;Fe(OH)3;
(2)NaOH固体配制250mL 6mol•L-1 的NaOH溶液,需要用到称量、溶解、移液以及定容等操作,除烧杯、玻璃棒外,还必需用到的玻璃仪器有250 mL容量瓶、胶头滴管,
故答案为:250 mL容量瓶、胶头滴管;
(3)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,所以废水处理流程中生成滤渣III的离子方程式为2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-,故答案为:2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-;
(4)用少量冷水洗涤Na2Cr2O7,可除去晶体表面残留的杂质,减小Na2Cr2O7的损耗,
故答案为:除去晶体表面残留的杂质,减小Na2Cr2O7的损耗;
(5)①焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,其反应的离子方程式为:3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O;
故答案为:3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O;
②pH约为8,则c(OH-)=10-6mol/L,已知Ksp[Cr(OH)3]≈6×10-31,c(Cr3+)=$\frac{6×1{0}^{-31}}{(1{0}^{-6})^{3}}$=6×10-13mol/L,则1L溶液中Cr元素的质量为6×10-13mol×52g/mol=3.12×10-11g=3.12×10-8mg,则理论上Cr3+浓度约为3.12×10-8mg/L,
故答案为:3.12×10-8.
点评 本题考查物质的制备的综合应用,为高频考点和常见题型,把握物质的制备方法、溶度积常数的计算为解答的关键,注意信息的应用及相关计算,侧重分析与实验、计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
 pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,其中A代表酸HA,B代表酸HB.下列说法正确的是( )
pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,其中A代表酸HA,B代表酸HB.下列说法正确的是( )| A. | 稀释前两酸溶液的物质的量浓度相等 | |
| B. | 稀释后,HA酸溶液的酸性比HB酸溶液强 | |
| C. | a=5时,HA是强酸,HB是弱酸 | |
| D. | 若有等浓度的NaA溶液和NaB溶液,则溶液的碱性NaA>NaB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷制一氯甲烷、苯制溴苯 | |
| B. | 乙醇制乙醛、乙醇和乙酸制乙酸乙酯 | |
| C. | 乙醇制乙烯、乙烯制乙醇 | |
| D. | 苯制环己烷、乙酸乙酯水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
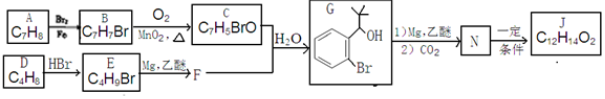

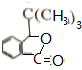 .
.
 反应①的反应条件和试剂分别为光照、Br2;L的结构简式为
反应①的反应条件和试剂分别为光照、Br2;L的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
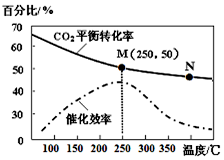 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在正极发生氧化反应 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 工作一段时间后电解质溶液中OH-的物质的量浓度增大 | |
| D. | 产物为无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
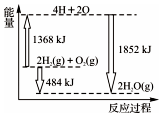
| A. | H2(g)和O2(g)反应生成H2O(g),这是个吸热过程 | |
| B. | 由2 mol H2和1 mol O2变成4 mol H、2 mol O原子,这是个放热过程 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 KJ能量 | |
| D. | 4 mol H、2 mol O生成2 mol H2O(g),共放出484 KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将混合气体通过盛有硫酸的洗气瓶 | |
| B. | 将混合气体通过盛有水的洗气瓶 | |
| C. | 将混合气体通过盛有足量溴水的洗气瓶 | |
| D. | 将混合气体通过盛有澄清石灰水的洗气瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com