
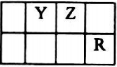
 己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:
己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答: .
.分析 X、Y、Z、Q、R是原子序数依次增大的短周期元素,R的单质常温下是一种黄绿色气体,则R为Cl,由元素相对位置可知Y为N元素、Z为O元素;X2Z2分子和Cl-离子具有相同的电子数,则X原子核外电子数为$\frac{18-8×2}{2}$=1,故X为H元素,X和Q位于同主族,Q的原子序数大于氧,故Q为Na.
解答 解:X、Y、Z、Q、R是原子序数依次增大的短周期元素,R的单质常温下是一种黄绿色气体,则R为Cl,由元素相对位置可知Y为N元素、Z为O元素;X2Z2分子和Cl-离子具有相同的电子数,则X原子核外电子数为$\frac{18-8×2}{2}$=1,故X为H元素,X和Q位于同主族,Q的原子序数大于氧,故Q为Na.
(1)Y为N元素,最外层电子数为5,位于周期表中的第VA族,故答案为:VA;
(2)化合物Na2O2中含有的化学键类型有:离子键、共价键,故答案为:离子键、共价键;
(3)用电子式表示化合物NaCl的形成过程: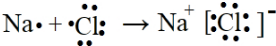 ,
,
故答案为: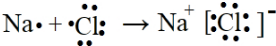 ;
;
(4)N2H4与AgNO3溶液反应可生成Ag、N2和硝酸,该反应的化学方程式:N2H4+4AgNO3=4Ag+N2↑+4HNO3,
故答案为:N2H4+4AgNO3=4Ag+N2↑+4HNO3.
点评 本题考查结构性质位置关系应用,以R单质的颜色为突破口进行推断,熟练掌握元素周期表与元素化合物的结构性质,注意掌握用电子式表示物质或化学键的形成.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 甲烷的熔沸点比硅烷的低 | |
| B. | NH3易液化 | |
| C. | NH3分子比PH3分子稳定 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶粒可以透过滤纸,不能透过半透膜 | |
| B. | 采用喷雾型药剂形成一定大小的液珠,可有效提高药物疗效 | |
| C. | 冶金工业的矿粒除尘利用了丁达尔效应 | |
| D. | 空气中的雾压现象体现了胶体的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁元素的化合价是+3 | |
| B. | 铁离子的配位数是3 | |
| C. | C2O42-中碳原子的杂化方式为sp3 | |
| D. | 该物质中含有离子键,配位键和极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2H2O+2OH-═2AlO2-+3H2↑ | |
| B. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
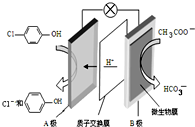 污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法不正确的( )
),其原理如图所示,下列说法不正确的( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A为电池的正极,发生还原反应 | |
| C. | A极的电极反应式为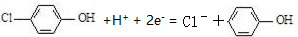 | |
| D. | 当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com