
【题目】工业上用废铁渣(含Fe2O3、FeO、Al2O3、MnO2、CuO、SiO2等杂质)制备绿矾(FeSO4·7H2O)并回收Cu的流程如图:
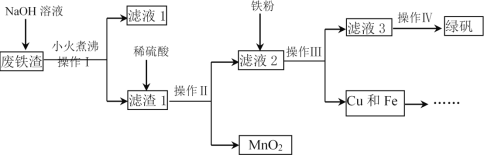
请回答下列问题:
(1)操作II所需的玻璃仪器有烧杯、玻璃棒和___。
(2)NaOH溶液的作用是溶解废铁渣中的___和___。
(3)写出向滤液2中加入铁粉的有关反应的离子方程式___(任写一个)。
(4)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。由此可知___。
【答案】漏斗 Al2O3 SiO2 Fe+2Fe3+=3Fe2+或Fe+Cu2+=Fe2++Cu或Fe+2H+=Fe2++H2↑ 绿矾中不含有Fe3+
【解析】
由流程可知,废铁渣与氢氧化钠溶液在小火煮沸的条件下,Al2O3和SiO2可溶于其中生成偏铝酸钠和硅酸钠,过滤后得到含有Fe2O3、FeO、MnO2、CuO的滤渣;再向滤渣中加入过量的稀硫酸,Fe2O3、FeO、CuO均可充分溶解,再过滤,过滤后的滤渣为 MnO2,向滤液2中加入过量的铁粉将硫酸铁和硫酸铜还原生成硫酸亚铁和铜,操作III仍是过滤,得到含有硫酸亚铁的滤液3,经蒸发浓缩、降温结晶、过滤、洗涤、干燥即可得到绿矾。
(1)操作II为过滤,所需的玻璃仪器有烧杯、玻璃棒和漏斗。
(2)Al2O3是两性氧化物,SiO2是酸性氧化物,其均可溶于NaOH溶液,因此,NaOH溶液的作用是溶解废铁渣中的Al2O3和SiO2。
(3)向滤液2中加入过量的铁粉将硫酸铁和硫酸铜还原生成硫酸亚铁和铜,过量的硫酸也会与铁粉发生反应,有关反应的离子方程式为Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑(任写一个)。
(4)Fe3++3SCN=Fe(SCN)3,该反应的发生可使溶液变为血红色,故常用加KSCN溶液检验Fe3+。在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。由此可知绿矾中不含有Fe3+。


科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是( )
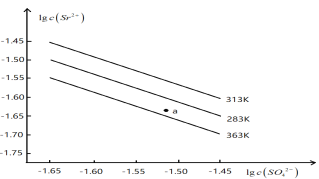
A. 温度一定时, Ksp(SrSO4)随c(SO42-)的增大而减小
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 363 K时,图中a点对应的溶液是不饱和溶液
D. 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。

回答下列问题:
(1)原料溶解过程中反应的离子方程式是_________________________。
(2)Al(OH)3 与稀硫酸反应的离子方程式是__________________________。
(3)溶液A中通入过量CO2,反应的离子方程式是_________________。
(4)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入___________,溶液立即变红,证明固体B中含有铁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)
A. 231.5mL B. 268.8mL C. 287.5mL D. 313.6mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
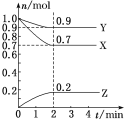
(1)由图中所给数据进行分析,该反应的化学方程式为____________________
(2)反应从开始至2min,用Z的浓度变化表示的平均反应速率为v(Z)=__________________。
(3)2min反应达平衡容器内混合气体的总压强比起始时________(填“增大”“减小”或“不变”);混合气体密度比起始时________(填“增大”“减小”或“不变”)。
(4)下列措施能加快反应速率的是________。
A.恒压时充入He B.恒容时充入He
C.恒容时充入X D.及时分离出Z
E.升高温度F.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答下列问题:
(1)实验中需用1mo/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为____________
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为_________________。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外还有________________。
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤: “操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共10g,得到的MgSO4·7H2O为17.22g,则MgSO4·7H2O的产率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应如下:
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g) ![]() H=-197 kJ/mol
H=-197 kJ/mol
下列说法正确的是
A. 因为反应放热,所以该反应不需要加热即能快速反应
B. 增大O2的浓度可以提高反应速率和SO2的转化率
C. 反应450℃时的平衡常数小于500℃时的平衡常数
D. 恒温下缩小容器容积,使Q > K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 硫化氢溶液呈酸性:H2S ![]() 2H++S2–
2H++S2–
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色) ![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热ΔH=–890.3 kJ·mol–1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–890.3 kJ·mol–1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32–+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,△S <0。
2NH3(g) △H<0,△S <0。
(1)下列关于工业合成氨的说法不正确的是_______
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______
a 容器内N2、H2、NH3的浓度之比为1:3:2 b v(N2)正= v(H2)逆
c 容器内压强保持不变 d 合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:
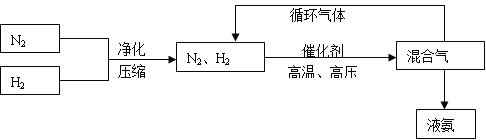
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因_______。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
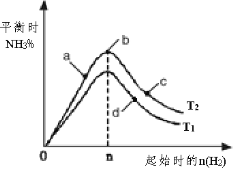
①图象中T2和T1的关系是:T2 __________T1(填“>,<或=”,下同)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是______(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=___________。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向_______反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) ![]() 2NH3(g) △H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的span>H2的物质的量为______mol。
2NH3(g) △H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的span>H2的物质的量为______mol。
(6)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com