
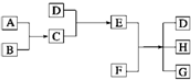
 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、②④⑤ |
| C、②③④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
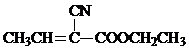 )是合成某种手术用粘合剂的单体,X的合成路线如图:
)是合成某种手术用粘合剂的单体,X的合成路线如图: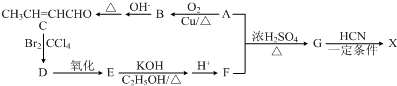

查看答案和解析>>
科目:高中化学 来源: 题型:
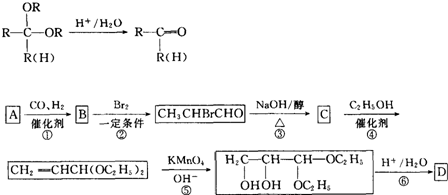
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在制备乙烯的实验中,为了防止反应产生副产物,加热时应使温度迅速上升至170°C |
| B、分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,并在水浴中加热,乙酸乙酯香味散失的速度按氢氧化钠、水、稀硫酸的顺序依次减慢 |
| C、将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 |
| D、向苯酚钠稀溶液中,通入少量二氧化碳气体,溶液中生成碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com