
| A. | X的两种氧化物中阴阳个数比均为1:2 | |
| B. | Y的氧化物熔点高,常用作耐高温材料 | |
| C. | Z的氧化物属于酸性氧化物,不能与任何酸反应 | |
| D. | R的同主族氢化物稳定性从上往下依次减弱 |
分析 X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,应是氢氧化铝与强碱、强酸的反应,故X为Na、Y为Al;Z的单质具有半导体的特性,则Z为Si;若W为P,则R为S或Cl,若W为S,则R为Cl,据此解答.
解答 解:X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,应是氢氧化铝与强碱、强酸的反应,故X为Na、Y为Al;Z的单质具有半导体的特性,则Z为Si;若W为P,则R为S或Cl,若W为S,则R为Cl.
A.X与氧元素形成的化合物有氧化钠、过氧化钠,两种氧化物中阴阳个数比均为1:2,故A正确;
B.Y为Al,氧化铝熔点很高,常用作耐高温材料,故B正确;
C.Z的氧化物为二氧化硅为酸性氧化物,但是二氧化硅能与氢氟酸反应,故C错误;
D.同主族从上到下元素的非金属性减弱,气态氢化物的稳定性减弱,故D正确.
故选:C.
点评 本题考查原子结构与元素周期律的关系,根据原子结构明确元素种类为解答该题的关键,注意把握原子结构特点以及元素周期律的递变规律,为解答该题的关键,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持温度和容器内压强不变,充入1molNH3(g) | |
| B. | 保持温度和容器内压强不变,充入1molAr(g) | |
| C. | 保持温度和容器体积不变,充入1molN2(g) | |
| D. | 保持温度和容器体积不变,充入1molNH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加前:c(NH4+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 滴加前:c(NH4+)+c(NH3•H2O)=c(SO42-) | |
| C. | 滴加至完全沉淀:c(OH-)>c(NH4+)>c(H+) | |
| D. | 滴加至中性:c(SO42-)=2c(NH4+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2作还原剂,铁元素被还原 | |
| B. | Fe2O3和SO2都既是氧化产物又是还原产物 | |
| C. | 每生成1 mol Fe2O3,有4mol硫被氧化 | |
| D. | 每1 mol硫被氧化,转移电子5.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
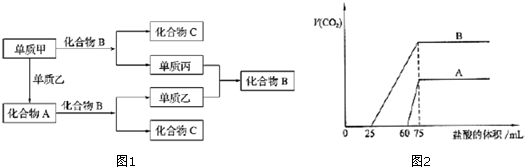
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电源有一次电池、二次电池和燃料电池等,一次电池只能放电,不能充电 | |
| B. | 铅蓄电池应用广泛,是一种常见的可充电电池,放电过程中电解质溶液密度逐渐增大 | |
| C. | 燃料电池具有能量利用率高、可连续使用和污染轻等优点 | |
| D. | 锂电池是一种高能电池,体积小、重量轻,单位质量电极放出的电能多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
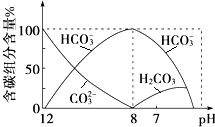 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 水电离出来的c(H+)=1.0×10-12mol/L的溶液中,Al3+不可能大量存在 | |
| C. | 0.1mol/L的氨水中滴加稀盐酸至过量,可能有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 在25℃时,将pH=5的醋酸溶液与pH=9的KOH溶液等体积混合,则充分反应后的混合液:c(CH3COO-)>c(H+)>c(K+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com