
【题目】根据下列实验操作回答有关问题:
(1)在盛有![]() 溶液的试管中逐滴滴加少量的
溶液的试管中逐滴滴加少量的![]() 溶液,可观察到的现象是______,该反应的离子方程式为______。
溶液,可观察到的现象是______,该反应的离子方程式为______。
(2)将(1)中所得的混合物平均分成两分,向其中一份中继续滴加![]() 溶液,直至过量,现象是______,反应的离子方程式为______;向另一份中加入足量稀硫酸,现象是______,反应的离子方程式为______。
溶液,直至过量,现象是______,反应的离子方程式为______;向另一份中加入足量稀硫酸,现象是______,反应的离子方程式为______。
(3)(2)中反应说明![]() 所属的物质类别是______。
所属的物质类别是______。
【答案】有白色沉淀生成 Al3++3OH-=Al(OH)3↓ 沉淀溶解 Al(OH)3+4OH-=[Al(OH)4]— 沉淀溶解 Al(OH)3+3H+=Al3++3H2O 两性氢氧化物
【解析】
(1)在盛有AlCl3溶液的试管中逐滴滴加少量的NaOH溶液,AlCl3溶液与少量的NaOH溶液反应生成氢氧化铝白色沉淀和氯化钠,反应的离子方程式为Al3++3OH-=Al(OH)3↓,故答案为:有白色沉淀生成;Al3++3OH-=Al(OH)3↓;
(2)将(1)中所得的混合物平均分成两分,向其中一份中继续滴加NaOH溶液,当AlCl3溶液完全反应生成氢氧化铝沉淀后,过量的氢氧化钠溶液与氢氧化铝沉淀反应,沉淀逐渐溶解,反应的离子方程式为Al(OH)3+4OH-=[Al(OH)4]—;向另一份中加入足量稀硫酸,稀硫酸与氢氧化铝沉淀生成硫酸铝和水,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:沉淀溶解;Al(OH)3+4OH-=[Al(OH)4]—;沉淀溶解;Al(OH)3+3H+=Al3++3H2O;
(3)氢氧化铝沉淀能溶于强碱氢氧化钠和强酸硫酸,说明氢氧化铝为两性氢氧化物,故答案为:两性氢氧化物。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】利用0.2mol·L1Al2(SO4)3溶液滴定0.05mol·L1 NaOH溶液。其pHt曲线如图所示。已知0.01mol·L1Al3+时,Al(OH)3沉淀存在的pH范围为4~10。下列说法正确的是( )

A.曲线段ab为未滴加Al2(SO4)3溶液,溶液只有Na+、OH
B.曲线段bc存在c(Na+)+c(H+)+3c(Al3+)=c(OH)+2c(SO42-)
C.曲线段cd发生反应为Al3++4OH=AlO2-+2H2O
D.曲线段de现象为产生白色沉淀,继而沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。
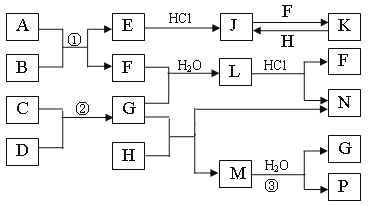
已知:E为红色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态;F、P和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)化合物A中含有的两种元素是___。
(2)F的化学式___;G的水溶液中,最多的阳离子是___。
(3)写出K与H反应的离子方程式:___。
(4)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。使用化学平衡移动原理加以解释___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
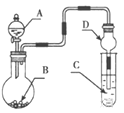
A.若A为H2O2,B为MnO2,C中盛有Na2S溶液, C中溶液变浑浊
B.若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C.若A为浓氨水,B为生石灰,C中盛有AlCl 3溶液, C中先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4 ,B为CaCO3,C中盛有Na2SiO3 溶液,C中溶液出现白色沉淀,证明非金属性S>C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述能说明氯元素原子得电子能力比硫元素原子强的是( )
①![]() 的溶解度比
的溶解度比![]() 大 ②
大 ②![]() 的酸性比氢硫酸强 ③
的酸性比氢硫酸强 ③![]() 的稳定性比
的稳定性比![]() 强 ④
强 ④![]() 的还原性比
的还原性比![]() 强 ⑤
强 ⑤![]() 的酸性比
的酸性比![]() 强 ⑥
强 ⑥![]() 与铁反应生成
与铁反应生成![]() ,而
,而![]() 与铁反应生成
与铁反应生成![]() ⑦
⑦![]() 能与
能与![]() 反应生成
反应生成![]() ⑧在元素周期表中
⑧在元素周期表中![]() 处于
处于![]() 同周期的右侧 ⑨还原性:
同周期的右侧 ⑨还原性:![]()
A.③④⑤⑦⑧⑨B.③④⑥⑦⑧
C.③⑥⑦⑧⑨D.①②③④⑤⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氢氧燃烧电池原理示意图,按照此图的提示,下列叙述正确的是( )
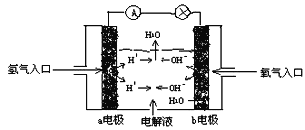
A. a电极是正极
B. b电极的电极反应为:4OH-- 4e-=2H2O + O2↑
C. 电子从a电极经由电解液传递到b电极
D. 氢氧燃烧电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C三种元素的原子中,质于数:A<B<C,且都小于18。A元素原子的最外层电子数是次外层电子数的2倍;B元素原子的M层电子数是L层电子数的一半;C元素原子的次外层电子数比最外层电子数多1。试回答下列问题。
(1)写出三种元素的名称和符号:A______,B______,C______。
(2)画出三种元素的原子结构示意图:A______,B______,C______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表),经X射线衍射测得R的局部结构如图所示,下列说法正确的是( )
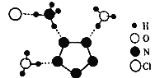
A.R中两种阳离子的中心原子的杂化轨道类型相同,但化学键类型不同
B.1molR中σ键总数为15个
C.N5-中参与形成的大π键电子数为6个
D.已知图中虚线代表氢键,其中一个表示为(NH4)N﹣H···Cl,则化合物R中共有4个不同类型氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com