
【题目】意大利科学家获得了极具研究价值的![]() 分子结构如图所示
分子结构如图所示![]() ,以下有关物质结构的说法正确的是( )
,以下有关物质结构的说法正确的是( )

A.N均是以![]() 杂化,
杂化,![]() 均为
均为![]() 键
键
B.N的电负性大于O,所以![]() 的沸点低于
的沸点低于![]()
C.![]() 为原子晶体,每个N的配位数为3
为原子晶体,每个N的配位数为3
D.N原子核外有5个未成对电子
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】下列图象与对应的说法正确的是![]()
A.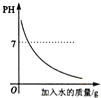 向NaOH溶液中加水稀释
向NaOH溶液中加水稀释
B. 等质量的Al、Zn与足量的稀硫酸反应
等质量的Al、Zn与足量的稀硫酸反应
C. 向稀硫酸中加入
向稀硫酸中加入![]() 溶液
溶液
D. 恒温下,适量蒸发饱和NaCl溶液的水分
恒温下,适量蒸发饱和NaCl溶液的水分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.H2SO4溶液与氢氧化钠反应:OH-+H+=H2O
B.铝与NaOH溶液反应:Al+2OH-= ![]() +H2↑
+H2↑
C.AlCl3溶液与氨水反应:AlCl3+3OH-=Al(OH)3↓+3Cl-
D.Cl2与氢氧化钠溶液反应:Cl2+2OH-=2ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为 C6H6的结构有多种,其中的两种为:
Ⅰ.![]() Ⅱ.
Ⅱ.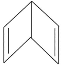
(1)这两种结构的化学性质区别表现在:Ⅰ不能____(填字母,下同),而Ⅱ能____。
A.被酸性KMnO4溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)已知Ⅰ结构下,该物质能在一定条件下与液溴反应,其反应方程式为________________。
(3)今发现C6H6还可能有另一种如下图所示的立体结构,该结构的四氯代物有______种。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成可再生能源甲醇。其工艺流程如图所示:
反应生成可再生能源甲醇。其工艺流程如图所示:
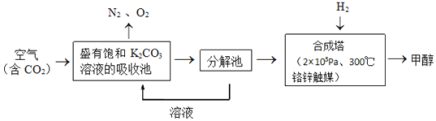
(1)分解池中主要物质是______;
(2)在合成塔中,若有![]() 与足量
与足量![]() 恰好完全反应,生成气态的水和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式______;
恰好完全反应,生成气态的水和甲醇,可放出5370kJ的热量,写出该反应的热化学方程式______;
(3)该工艺在那些方面体现了“绿色自由”构想中的“绿色”______。(答二条)
(4)一定条件下,向2L恒容密闭容器中充入1mol![]() 和3mol
和3mol![]() ,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内
,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内![]() 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

![]() 图中c点的转化率为
图中c点的转化率为![]() ,即转化了
,即转化了![]()
①催化剂效果最佳的反应是______ (填“反应I”,“反应II”,“反应III”)。
②b点v (正)______ v (逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是______。
④c点时该反应的平衡常数K=______。
⑤一定条件下,向2L恒容密闭的上述容器中再充入1mol![]() 和3mol
和3mol![]() ,达到新的化学平衡后,
,达到新的化学平衡后,![]() 的浓度较原平衡浓度______
的浓度较原平衡浓度______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
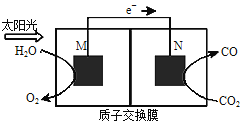
(5)科学家还研究了其它转化温室气体的方法,利用图所示装置可以将![]() 转化为气体燃料
转化为气体燃料![]() 该装置工作时,N电极的电极反应式为______。
该装置工作时,N电极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为 -69℃和58℃,写出该反应的热化学方程式___________。
(2)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,其电子式为______________。
(3)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价的含氧酸盐,消耗1.0L 2.2molL-1NaOH溶液和1.0molO2,则两种气体中相对分子质量小的气体物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+ 4B(g)![]() C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl微溶于水,不溶于稀酸,可溶于Cl-浓度较大的体系,在潮湿的空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
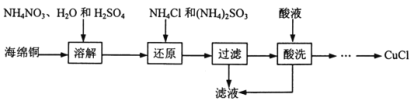
(1)基态铜原子核外电子排布式为:________。
(2)为了提高溶解速率,可以适当加热到60~70℃,还可以采用的措施为________。
(3)溶解步骤的温度控制在60~70℃,温度不宜过高的原因是________。该步骤中Cu 与NH4NO3反应的离子方程式为 (N元素被还原到最低价)_________________。
(4)还原步骤发生反应的离子方程式为______________________。
(5)滤液的主要成分为__________(写化学式)。
(6)酸洗时,可选用稀硫酸或稀盐酸,但不能用浓盐酸的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
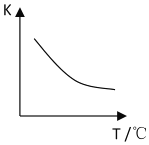
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com