
��14�֣���1����һ���¶��£���1L����̶����ܱ������м���1mol A��g����������Ӧ2A��g�� B��g��+C��g����B�����ʵ�����ʱ��ı仯��ͼ��ʾ�� 0��2min�ڵ�ƽ����Ӧ����v(A)= .
��ͬ�¶��£�����ʼ����A��g�������ʵ�����ԭ����2������ƽ��ʱ ��ԭ����2����
B��g��+C��g����B�����ʵ�����ʱ��ı仯��ͼ��ʾ�� 0��2min�ڵ�ƽ����Ӧ����v(A)= .
��ͬ�¶��£�����ʼ����A��g�������ʵ�����ԭ����2������ƽ��ʱ ��ԭ����2����
a.ƽ�ⳣ�� b. A��ƽ��Ũ��
c.ƽ��ʱ���������ܶ� d.ƽ��ʱB���������
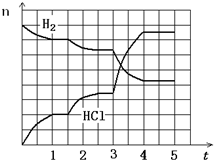
��2��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ�� �ƶ�����������ҡ������������������������Լ��е� ������H2�����ʽ�����
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
e. CH3COOH
��3���ö��Ե缫���Cu(NO3)2 ��Һһ��ʱ�����a mol ��Cu(OH)2��ʹ��Һ�ָ�ԭ״�����������ת�Ƶĵ�����ĿΪ_____________
��4����֪��2Zn��s��+O2��g��=2ZnO��s�� ��H=-701.0kJ��mol-1
2Hg��l��+O2��g��=2HgO��s�� ��H=-181.6kJ��mol-1
��ӦZn��s��+ HgO��s��=ZnO��s��+ Hg��l�� ��H=_____________
��5����֪25��ʱ��Ksp[Cu(OH)2]��2��10��20,Ҫʹ0.2 mol��L��1 CuSO4��Һ��Cu2��������Ϊ��ȫ��ʹCu2��Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ�����NaOH��Һ��ʹ��Һ��pHΪ��������������
����14�֣���1��0.1mol/(L��min) �� b c ��2������ �� b
��3��4a NA ��4����259��7 kJ��mol-1 ��5��6
����������1����0��2min��B������0.1mol������ݷ�ӦʽA������0.2mol��������Ӧ������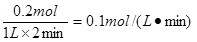 �����ڷ�Ӧǰ��������䣬��������ʼ����A��g�������ʵ�����ԭ����2������ƽ��ʱA��ƽ��Ũ�Ⱥ�ƽ��ʱ���������ܶȶ���ԭ����2����ac���Dz���ģ���ѡbc��
�����ڷ�Ӧǰ��������䣬��������ʼ����A��g�������ʵ�����ԭ����2������ƽ��ʱA��ƽ��Ũ�Ⱥ�ƽ��ʱ���������ܶȶ���ԭ����2����ac���Dz���ģ���ѡbc��
��2��п��ϡ���ᷴӦ��������������Һ�������ӵ�Ũ�Ƚ��ͣ�����ˮ�ĵ���ƽ��������Ӧ�����ƶ����������ƶ���b���Թ���ͭпԭ��أ��ӿ췴Ӧ���ʡ�a�в��ٲ���������b��Ӱ�죬d�����������ӣ����Ʒ�Ӧ���ʡ����������ᣬ�������������ӵ�Ũ�ȣ���ѡb��
��3����a mol ��Cu(OH)2��ʹ��Һ�ָ�ԭ״��˵���ڷ�Ӧ������������������������ʼ����OH���ŵ����������a mol Cu(OH)2�к���2amol��ԭ�ӣ����Է�Ӧ��ת�Ƶĵ�����2amol��2��4amol��
��4�������˹���ɵ�Ӧ�ã����٣��ڣ���2���õ�Zn��s��+ HgO��s��=ZnO��s��+ Hg��l�������Է�Ӧ���ǣ���701.0kJ��mol-1��181.6kJ��mol-1����2����259��7 kJ��mol-1.
��5�������ܶȻ������ı���ʽ��֪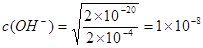 ����������Ũ����
����������Ũ����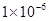 ������pH��6.
������pH��6.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?�Ӷ���һģ����ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��
��2013?�Ӷ���һģ����ҵ�ϸߴ������ͨ�����з�Ӧ��ȡ��| ���� |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| [CO2]3 |
| [CO]3 |
| [CO2]3 |
| [CO]3 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com