
 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:分析 常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2;甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可甲能是Al2O3,则丙是H2O,B是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,验证符合转化关系,以此解答该题.
解答 解:(1)由以上分析可知A为Al,乙为NaAlO2,故答案为:Al;NaAlO2;
(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②乙溶液中通入过量CO2反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)产生的H2在标准状况下的体积为67.2L,物质的量为$\frac{67.2L}{22.4L/mol}$=0.3mol,根据2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,消耗的Al的物质的量为3mol×$\frac{2}{3}$=2mol,转移电子数目为2mol×3=6mol,数目为6NA,故答案为:2mol; 6NA.
点评 本题考查无机物推断,为高考常见题型,涉及Al元素单质化合物的性质,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,Al与碱的特殊的反应是推断的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CO32-+H+=HCO3- | B. | HCO3-+3CO32-+7H+═4CO2↑+4H2O | ||
| C. | 2HCO3-+5CO32-+12H+═7CO2↑+7H2O | D. | HCO3-+CO32-+3H+═2CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的Fe2+全部作还原剂 | |
| B. | 生成1.5molFe3O4时,反应转移电子 6mol电子 | |
| C. | 方程式中a=2 | |
| D. | 反应中被氧化的元素是Fe,被还原的元素是S和O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实际应用 | 化学原因 | |
| A | “84”消毒液和洁厕灵不能混合使用 | 发生化学反应产生有毒气体 |
| B | FeCl3腐蚀Cu刻制印刷电路板 | 铁比铜金属性强 |
| C | 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | 酸、碱还有盐可直接侵蚀铝的保护膜以及铝制品本身 |
| D | 明矾、硫酸铁可作净水剂 | 溶于水形成胶体从而凝聚水中的悬浮物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Fe3+、Cu2+ | B. | Fe2+、Cu2+、Fe3+ | C. | Cu2+、Fe2+、Fe3+ | D. | Fe3+、Cu2+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 熟石膏转化为生石膏 | |
| D. | 工业制液态氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
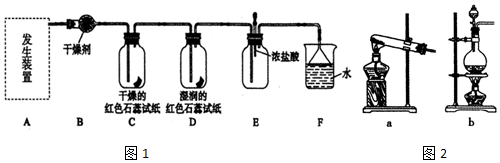
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com