
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
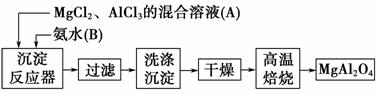
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
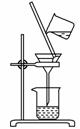
(2)如下图所示,过滤操作中的一处错误是________。
(3)判断流程中沉淀是否洗净所用的试剂是________。高温焙烧时,用于盛放固体的仪器名称是________。
(4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

装置B中盛放饱和NaCl溶液,该装置的主要作用是______________________ ________________________________________________________。
F中试剂的作用是_________________________________________________,
用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是 ( )。
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HClO)
C.滴加AgNO3溶液生成白色沉淀(Cl-)
D.向FeCl2溶液中滴加氯水后,再滴加KSCN溶液,发现呈红色(HCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了如下实验测量m g铜银合金样品中铜的质量分数:

下列说法中不正确的是 ( )。
A.合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性
B.铜银都能与稀硝酸反应,收集到的V L气体可能全为NO
C.操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ应是烘干
D.根据反应收集到的气体体积可以计算铜和银的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2 mL 1 mol·L-1 FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH________7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:___________________________。
②乙同学认为可能是发生了氧化还原反应,其中Fe3+→Fe2+;请写出Fe3+跟SO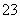 反应的离子方程式_____________________________________________
反应的离子方程式_____________________________________________
________________________________________________________。
乙同学查阅资料得知:
| 1.Fe2+与SO 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol·L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
②请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因____________________。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有a mol AlCl3的溶液中加入含b mol KOH的溶液,生成沉淀的物质的量可能是 ( )。
①a mol ②b mol ③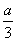 mol ④
mol ④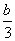 mol ⑤0 mol ⑥(4a-b) mol
mol ⑤0 mol ⑥(4a-b) mol
A.①②④⑥ B.①③④⑤⑥
C.②③⑤⑥ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的Na2O2与CO2反应后的固体物质41.8 g,恰好与1 L 1 mol·L-1的稀盐酸完全反应,下列说法正确的是 ( )。
A.41.8 g固体物质为Na2CO3
B.41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物
C.41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物
D.一定量的Na2O2为78 g
查看答案和解析>>
科目:高中化学 来源: 题型:
钠是很活泼的金属,在空气中燃烧的产物是Na2O2。Na2O的制取可以通过如下反应完成:Na+NaNO3 Na2O+N2↑(未配平)。请回答下列问题:
Na2O+N2↑(未配平)。请回答下列问题:
(1)上述反应的氧化剂是________(写化学式)。制取Na2O时,若金属钠与NaNO3按质量比23∶17投料,充分反应后收集到的气体体积为1.12 m3(标准状况下),则制得的Na2O的质量为________ kg。
(2)制取Na2O时由于设备密封性不好而进入了少量空气,导致制得的Na2O产品中含有Na2O2杂质。现有Na2O产品m g(假设只含有Na2O2杂质),请从下面选用合适的仪器和试剂,设计一种可选用的实验仪器组合,以完成样品中Na2O含量的测定。

可选用的试剂:
a.浓硫酸 b.水 c.盐酸标准溶液 d.NaOH标准溶液
e.酚酞 f.碱石灰 g.稀盐酸
| 实验过程中发生反应的化学方程式 | 实验所需仪器(用字母表示) | 实验所需试剂(用字母表示) | 实验需直接测定的有关物理量(用文字说明) |
(3)某学生设计了以下实验方案来测定该试样中Na2O的质量分数,其操作流程和实验数据如下:

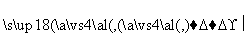



该Na2O产品中Na2O的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.根据1H核磁共振谱图可以推知有机物分子中有几种不同类型的氢原子
B.红外光谱是用高能电子流等轰击样品分子,使分子失去电子变成分子、离子或碎片离子
C.元素分析仪具有快速、微量、精确等特点
D.通过红外光谱可以测知有机物所含的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
A.1∶7 B.7∶1 C.7∶8 D.8∶7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com