
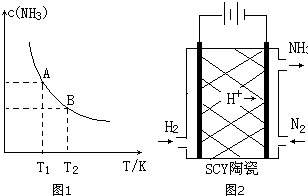
 ��1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
��1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��| 2n |
| (1-n)mol+(3-3n)mol+2nmol |
| ||
| 5.00min |
(
| ||||
|


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����״���£�5.6L���Ȼ�̼���еķ�����Ϊ0.25NA |
| B��32g O2��O3��������к���ԭ����Ϊ2NA |
| C��2.4g����þ��Ϊþ����ʱʧȥ�ĵ�����Ϊ0.1NA |
| D�����ʵ���Ũ��Ϊ0.5 mol/L��MgCl2��Һ�У�����Cl-����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 3 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��-332 | B��-118 |
| C��+350 | D��+130 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
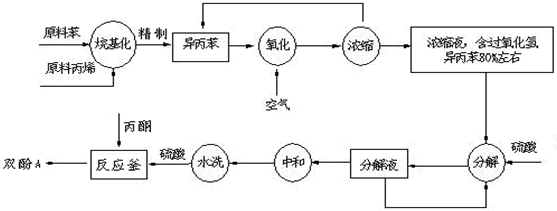
 ��2�������������У���Ҫ�ϸ�����¶ȣ���ֹ�¶ȹ��ߣ���ԭ���ǣ��ٷ�ֹ��Ӧ���ھ��Ң�
��2�������������У���Ҫ�ϸ�����¶ȣ���ֹ�¶ȹ��ߣ���ԭ���ǣ��ٷ�ֹ��Ӧ���ھ��Ң��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ø�ԭ����ʵ��һ�ֳ���ת��Ϊ�����ܵij��� |
| B���ù����ƻ���ZnS���ܽ�ƽ�� |
| C����ɫ����ΪZnS������ɫ����ΪCuS |
| D����������˵��ZnS��KspС��CuS��Ksp |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com