
下列化学反应的速率,一定是前者大于后者的( )
|
| A. | 反应A+B |
|
| B. | 相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 |
|
| C. | 相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 |
|
| D. | 一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.11.2 L H2中含有氢原子的个数为NA
B.在标准状况下22.4 L H2O中含有氢原子的个数为2NA
C.32 g O3中含有氧原子的个数为2NA
D.1 mol/L NaCl溶液中含有钠离子的个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是( )
|
| A. | 向饱和Na2CO3中加入过量CO2气体:CO32﹣+CO2+H2O=2HCO3﹣ |
|
| B. | 在沸水中滴入饱和FeCl3溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3(胶体)+3H+ |
|
| C. | 4mol/L的NaAlO2溶液和7mol/L的盐酸等体积混合:4AlO2﹣+7H++H2O=3Al(OH)3↓+Al3+ |
|
| D. | 酸化的KMnO4溶液与H2O2反应:2MnO4﹣+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)⇌xC(g)+D(s),向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C和2mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是( )
|
| A. | 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4 |
|
| B. | 平衡时,甲、乙两容器中A、B的物质的量之比不相等 |
|
| C. | 平衡时甲中A的体积分数为40% |
|
| D. | 若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);△H<0(kJ•mol﹣1)的化学反应,下列叙述一定正确的是( )
|
| A. |
反应过程中能量关系可用右图表示 |
|
| B. | 1mol锌的能量高于1molH2所含的能量 |
|
| C. | 若将该反应设计成原电池,则锌为正极 |
|
| D. | 若将其设计为原电池,则当有32.5g锌溶解时,正极放出的气体体积一定为22.4L(标况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列实验的描述正确的是( )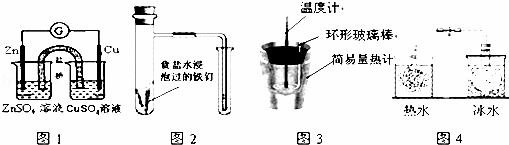
|
| A. | 图1所示的实验:根据电流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性 |
|
| B. | 图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
|
| C. | 图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热 |
|
| D. | 图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)⇌N2O4(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解的催化效果强弱,甲乙两组同学分别设计了如图一、图二所示的实验.
(1)图一可通过观察 (现象)定性比较得出结论.有同学提出将CuSO4改为CuCl2或将FeCl3改为浓度相当的Fe2(SO4)3更为合理,其理由是: .
(2)图二所示实验中需测量的数据是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化热是指一定条件下,1mol不饱和化合物加氢时放出的热量.表中是环己烯( )、环己二烯(
)、环己二烯( )和苯的氢化热数据:
)和苯的氢化热数据:
| 物质 |
|
|
|
| 氢化热(kJ/mol) | 119.7 | 232.7 | 208.4 |
根据表中数据推断正确的是( )
|
| A. | 环己二烯与H2的反应最剧烈 |
|
| B. | 环己烯、环己二烯和苯有相同的官能团 |
|
| C. | 三种化合物中环己二烯的稳定性最强 |
|
| D. | 上述条件下,1 mo |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学式为C6H12的某烯烃的所有碳原子都在同一平面上,则该烯烃的结构简式为___________________,其名称为______________;在核磁共振氢谱图上应该出现_____个峰。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com