
| A. | 需要配置480mL该溶液,应选用500mL容量瓶 | |
| B. | 固体NaOH须放到烧杯中称量 | |
| C. | 把称好的固体加水溶解后马上转移到容量瓶中 | |
| D. | 定容时俯视刻度线,所配NaOH溶液浓度会偏大 |
分析 A、容量瓶只有一条刻度线,且实验室无480mL容量瓶;
B、氢氧化钠固体易潮解;
C、固体溶于水后通常放热或吸热;
D、定容时俯视刻度线,会导致溶液体积偏小.
解答 解:A、容量瓶只有一条刻度线,且实验室无480mL容量瓶,故应根据“大而近”的原则来选取500mL容量瓶,故A正确;
B、氢氧化钠固体易潮解,故称量时要将氢氧化钠固体放在烧杯中称量,故B正确;
C、固体溶于水后通常有热效应,会放热或吸热,故应将溶液放置至室温后再移液,故C错误;
D、定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大,故D正确.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的操作正误分析,属于基础型题目,难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、氯化钙 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要摄入反式脂肪酸,就一定会患上心血管疾病 | |
| B. | 氢化是一种把液态植物油转化成固态或半固态脂肪的化学工艺 | |
| C. | 奶油、代可可脂巧克力、乳饮料、奶茶、蛋黄派等零食都可能含有反式脂肪酸 | |
| D. | 食品标签里的氢化植物油、植脂末、起酥油、代可可脂等都可能是反式脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有SO2、NH3和NO | B. | 一定有NO和HCl | ||
| C. | 可能有Cl2和O2 | D. | 一定没有Cl2、NO2、NH3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
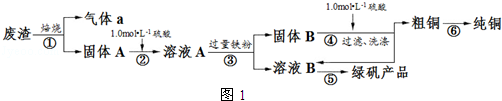
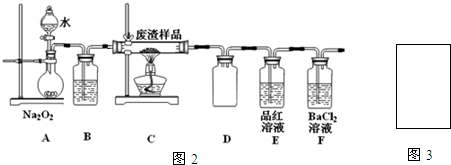
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+H2O?H2SO3 | B. | SO2+2NaOH?Na2SO3+H20 | ||
| C. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3 | D. | SO2+CaO═CaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
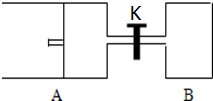 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0达到平衡时,V(A)=1.2aL.试回答:
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0达到平衡时,V(A)=1.2aL.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
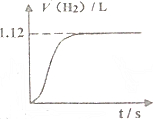 常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)
常温下在1LpH=3的HA溶液中加入过量铁粉,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com