
| A. | 以Y浓度变化表示的反应速率为0.005mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若升高温度Y的转化率减小,则正反应为放热反应 | |
| D. | 达到平衡时,X与Y的浓度相等 |
分析 A.先根据生成Z的物质的量计算出消耗Y的物质的量,然后根据v=$\frac{\frac{△n}{V}}{△t}$计算出以Y浓度变化表示的反应速率;
B.体积变为20L,体系的压强减小,平衡向着逆向移动,Z的浓度减小;
C.根据升高温度平衡向逆反应方向移动判断反应热;
D.达到平衡时,X、Y的浓度不一定相等,和起始量有关.
解答 解:A.达到平衡时生成0.3molZ,则消耗Y的物质的量为0.6mol,所以以Y浓度变化表示的反应速率为:v(Y)=$\frac{\frac{0.6mol}{10L}}{60s}$=0.001mol/(L•s),故A错误;
B.该反应是气体体积缩小的反应,容器的体积变为20L,体系的压强减小,平衡向着逆向移动,则Z的浓度减小,所以Z的平衡浓度小于原来的$\frac{1}{2}$,故B错误;
C.升高温度,Y的转化率减小,说明升高温度平衡向逆反应方向移动,则正反应的△H<0,该反应为放热反应,故C正确;
D.没有告诉X、Y的起始浓度,则达到平衡时,X、Y的浓度不一定相等,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学平衡及其影响、化学反应速率的计算、化学平衡状态的判断等知识,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅥA | ⅦA | O | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
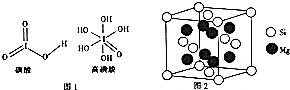 世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等.
世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | V=40 | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
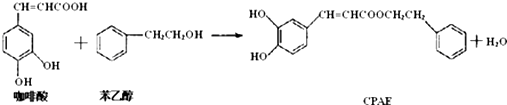
| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 与苯乙醇互为同分异构体的酚类物质共6种 | |
| D. | 1molCPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y的氢化物比同族氢化物的沸点均高 | |
| B. | X、Y、Z形成的化合物不止一种 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应的水化物化学式为H2YO3 | |
| B. | 元素Y和W的非金属性强弱比较:Y<W | |
| C. | 原子半径由小到大的顺序为:Y<X<W<Z | |
| D. | X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com