
向某FeBr2溶液中,通入1.12 L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3 mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是( )
A.原溶液的浓度为0.1 mol/L
B.反应后溶液中c(Fe3+)=0.1 mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4 mol/L
解析:当n(FeB r2)∶n(Cl2)≥2∶1时,反应为:6FeBr2+3Cl2===2FeCl3+4FeBr3此种情况下n(Br-)/n(Cl-)≥2∶1;当n(FeBr2)∶n(Cl2)≤2∶3时,反应为2FeBr2+3Cl2===2FeCl3+2Br2,溶液中没有Br-;由此可知,当c(Br-)=3c(Cl-)时,说明通入Cl2不足,发生前者的反应,且Fe2+没有完全被氧化。由前者反应化学方程式可知c(Cl-)=0.1 mol/L时,c(Fe3+)=0.1 mol/L。0.05 mol Cl2反应后n(Cl-)=0.1 mol,所以V(aq)=1 L。n(Br-)=0.3 mol,原溶液c(FeBr2)=0.15 mol/L,被氧化的Fe2+是0.1 mol,所以反应后c(Fe3+)=2c(Fe2+)。
r2)∶n(Cl2)≥2∶1时,反应为:6FeBr2+3Cl2===2FeCl3+4FeBr3此种情况下n(Br-)/n(Cl-)≥2∶1;当n(FeBr2)∶n(Cl2)≤2∶3时,反应为2FeBr2+3Cl2===2FeCl3+2Br2,溶液中没有Br-;由此可知,当c(Br-)=3c(Cl-)时,说明通入Cl2不足,发生前者的反应,且Fe2+没有完全被氧化。由前者反应化学方程式可知c(Cl-)=0.1 mol/L时,c(Fe3+)=0.1 mol/L。0.05 mol Cl2反应后n(Cl-)=0.1 mol,所以V(aq)=1 L。n(Br-)=0.3 mol,原溶液c(FeBr2)=0.15 mol/L,被氧化的Fe2+是0.1 mol,所以反应后c(Fe3+)=2c(Fe2+)。
答案:B


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
最新执行的国家食品卫生标准规定,酱油中3-氯丙醇(ClCH2CH2CH2OH)含量不得超过1ppm。相对分子质量为94.5的氯丙醇(不含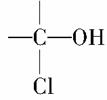 )共有( )
)共有( )
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
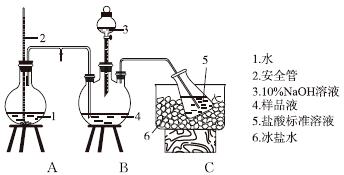
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化工生 产过程中所发生的反应不属于氧化还原反应的是( )
产过程中所发生的反应不属于氧化还原反应的是( )
A.用氯气和消石灰制漂白粉 B.用氢气和氮气合成氨
C.用铝土矿冶炼金属铝 D.用油脂制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影3区域的是( )
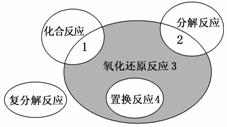
A.Cl2+2NaI===2NaCl+I2
B.NH4HCO3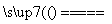 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.Fe2O3+3CO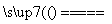 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,这是因为________________________________________________________,
离子方程式为_________________________________________________________。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为________________________________________________________________________,
离子方程式是____________________________________________________________。
③对比①和②实验所得的结果,将I2、ClO-、SO 按氧化性由强到弱的顺序排列为____________。
按氧化性由强到弱的顺序排列为____________。
(2)设计实验证明以下事实并写出化学反应方程式。
①浓硫酸的氧化性比稀硫酸强。
②氯化铁溶液中Fe3+的氧化性比硫酸铜溶液中的Cu2+强。
③铁的还原性比铜强。
查看答案和解析>>
科目:高中化学 来源: 题型:
欲从苯酚的乙醇溶液中回收苯酚,有下列操作:
①蒸馏;②过滤;③分液;④加入足量的钠;⑤通入过量的CO2;⑥加入足量的NaOH溶液;⑦加入足量的FeCl3溶液;⑧加入乙醇和浓硫酸的混合液;⑨加入足量的浓溴水;⑩加入适量盐酸。
合理的步骤是( )
A.④⑤⑩ B.⑥①⑤③
C.⑨②⑧① D.⑦①③⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如右图所示,关于该电池的叙述正确的是
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O == Mg(OH)2↓+ Cl-

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com