
 ;
;分析 A、B、C、D、E五种短周期元素的原子序数依次增大,A2-与B+具有相同的核外电子层结构.D的最高价氧化物对应的水化物具有两性,则D为Al;A2-与B+具有相同的核外电子层结构,二者原子序数小于Al,可推知A为O元素、B为Na;C的原子序数介于钠、铝之间,则C为Mg;A、B、E的原子序数之和为36,则E的原子序数为36-8-11=17,则E为Cl.
解答 解:A、B、C、D、E五种短周期元素的原子序数依次增大,A2-与B+具有相同的核外电子层结构.D的最高价氧化物对应的水化物具有两性,则D为Al;A2-与B+具有相同的核外电子层结构,二者原子序数小于Al,可推知A为O元素、B为Na;C的原子序数介于钠、铝之间,则C为Mg;A、B、E的原子序数之和为36,则E的原子序数为36-8-11=17,则E为Cl.
(1)A为O元素、C为Mg,E为Cl,故答案为:O;Mg;Cl;
(2)E的阴离子为Cl-,离子结构示意简图为: ,故答案为:
,故答案为: ;
;
(3)A的单质与B的单质在点燃条件下反应,生成物的化学式为Na2O2,故答案为:Na2O2;
(4)D的单质与四氧化三铁高温下反应的化学方程式为:8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,若反应物恰好完全反应,则D的单质与四氧化三铁的质量比为:27g/mol×8mol:232g/mol×3mol=9:29,
故答案为:8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;9:29.
点评 本题考查结构性质位置关系应用,注意抓住短周期元素,D的最高价氧化物对应的水化物具有两性为推断突破口,结合离子所带电荷判断.


科目:高中化学 来源: 题型:解答题
 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱可做食品干燥剂 | B. | 经常接触铅笔芯易造成铅中毒 | ||
| C. | 盐类都可以用作调味品 | D. | 蚕丝的主要成分是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
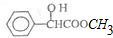
| A. | 分子式为C9H10O3 | |
| B. | 可以发生取代反应、加成反应、氧化反应和还原反应 | |
| C. | 1mol该物质最多可与4mol H2发生加成反应 | |
| D. | 其苯环上的二氯代物共有六种结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
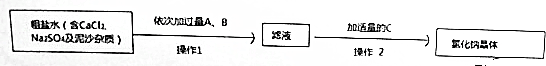
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
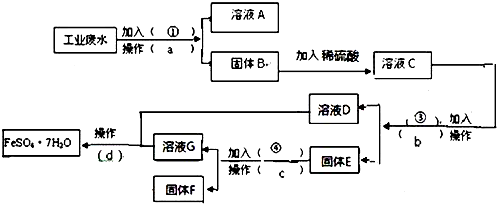
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com