
分析 (1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热.利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减,据此书写判断;
(2)利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
(3)根据化学平衡的三段法计算、平衡常数的计算来分析,平衡常数受温度的影响,据此分析解答.
解答 解:(1)已知:①2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ•moL-1
②H2O (g)=H2O(l)△H=-44.0KJ•moL-1
根据盖斯定律,①×$\frac{1}{2}$+②得H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=$\frac{1}{2}$×(-483.6KJ•moL-1)+(-44.0KJ•moL-1)=-285.8KJ•moL-1;
故答案为:-285.8kJ•moL-1;
(2)已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ•moL-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ•moL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ•moL-1-(-483.6KJ•moL-1)=-82.4KJ•moL-1.
即CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1.
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ•moL-1;
(3)CO(g)+H2O(g)═CO2(g)+H2(g)
开始 0.2 1 0 0
转化 x x x x
平衡 0.2-x 1-x x x
t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则$\frac{x×x}{(0.2-x)×(1-x)}$=1,
解得x=$\frac{1}{6}$,所以CO的转化率为$\frac{\frac{1}{6}}{0.2}$×100%=83.3%,
该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,
故答案为:83.3%;变小;逆.
点评 本题考查燃烧热概念、热化学方程式书写与计算、化学平衡的计算及移动,是对知识的综合应用,题目难度中等,注意理解把握燃烧热的概念.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向硝酸溶液中加入碳酸钠,有大量气泡产生 | 酸性:碳酸>硝酸 |
| B | 向1mL 某溶液中,滴入2mL 0.1mol•L-1 NaOH溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体 | 某溶液中含NH4+ |
| C | 取5mL 0.1mol•L-1FeCl3溶液,滴加5滴0.1mol•L-1KI溶液,振荡,再加入5mL CCl4,振荡,静置,取上层液体,向取出来的溶液中滴加KSCN溶液,显血红色. | KI和FeCl3反应有一定的限度 |
| D | 加热使冰化成液态水 | 分子内H-O键发生断裂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉生产车间应严禁烟火 | |
| B. | NH3泄露时向空中喷洒水雾 | |
| C. | 含Cl2的尾气用碱溶液处理后再排放 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
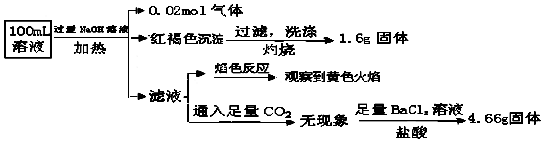
| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
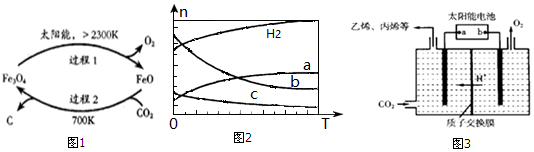
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
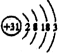 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH) 3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol C4H10中含有的共价键数为6.5NA | |
| B. | 3.4 g羟基和3.4 g氢氧根均含有2NA个电子 | |
| C. | 1L0.1 mol•L-1CH3COOH溶液中含有的氧原子数为0.2NA | |
| D. | 标准状况下,22.4L由CHCl3和CH2Cl2组成的混合物中含有的分子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com