
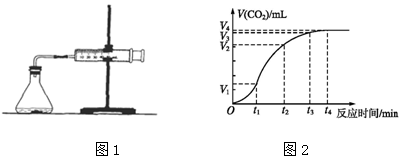
分析 (1)根据图象知,曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大;温度越高,反应速率越快;
(2)降低反应速率,可以通过减小溶液中氢离子浓度实现;
(3)根据二氧化碳的体积计算参加反应的HCl的物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算盐酸的反应速率.
解答 解(1)曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大,根据图象知,斜率最大的是t1~t2;该反应是放热反应,放出的热量使溶液温度升高,升高温度,反应速率加快,
故答案为:B;反应放热,使反应速率加快;
(2)降低反应速率,可以通过减小溶液中氢离子浓度实现,加水稀释或加入氯化钠溶液都能使氢离子浓度降低,从而降低反应速率,通入氯化氢使溶液中氢离子浓度增大,反应速率加快,故选AC;
(3)t1~t2时间生成气体体积=(V-V1)mL,则二氧化碳的物质的量=$\frac{{V}_{2}-{V}_{1}}{22.4}$×10-3mol,根据HCl和二氧化碳的关系式知,消耗盐酸的物质的量=(2×$\frac{{V}_{2}-{V}_{1}}{22.4}$×10-3)mol,盐酸的反应速率=$\frac{\frac{2({V}_{2}-{V}_{1})×1{0}^{-3}}{22.4}}{\frac{0.02}{{t}_{2}-{t}_{1}}}$mol/(L.min)=$\frac{{V}_{2}-{V}_{1}}{224({t}_{2}-{t}_{1})}$,
故答案为:$\frac{{V}_{2}-{V}_{1}}{224({t}_{2}-{t}_{1})}$.
点评 本题考查了化学反应速率的影响因素、根据方程式进行计算,知道浓度、温度对化学反应速率任何改变,再结合速率公式分析解答,知道斜率与速率的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素X:位于元素周期表中的第三周期ⅢA 族 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氖原子相同 | |
| C. | 元素Z:它的原子中M层比L层少2个电子 | |
| D. | 元素W:它的化合物的焰色反应颜色呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| B | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊不消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊;再加入品红溶液,溶液为红色 | Ca(ClO)2溶液 |
| D | 通入SO2,溶液没有明显变化;再通入氨气,溶液变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯分子中含有碳碳双键数为3NA | |
| B. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA | |
| C. | 14 g乙烯和丙烯的混合气体中所含原子总数为2NA | |
| D. | 标准状况下,22.4 L己烷中共价键数目为19NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B>A | |
| B. | 原子序数:D>C>B>A | |
| C. | 原子半径:A>B>C>D | |
| D. | 最高价氧化物的水化物碱性:A>B,酸性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Na+) | B. | n(Cl-) | C. | c(OH-) | D. | c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com