把6molCu粉投入含8molHNO3和2molH2SO4的稀溶液中,则标准状况下放出的气体的物质的量为________.
3mol
分析:先计算氢离子的物质的量,再根据溶液中发生3Cu+8H
++2NO
3?=3Cu
2++2NO↑+4H
2O,判断过量,将不足的代入离子反应方程式来计算.
解答:n(Cu)=6mol,n(NO
3-)=8mol,n(H
+)=8mol+2×2mol=12mol,
由3Cu+8H
++2NO
3?=3Cu
2++2NO↑+4H
2O可知,
6molCu反应需要消耗4molNO
3?,消耗16molH
+,显然H
+不足,
设放出的气体的物质的量为x,则
3Cu+8H
++2NO
3?=3Cu
2++2NO↑+4H
2O
8 2
12mol x
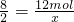
,解得x=3mol,
故答案为:3mol.
点评:本题考查学生利用离子反应方程式进行的计算,明确离子的物质的量及判断过量是解答本题的关键,并学会利用离子反应来分析解答问题.

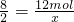 ,解得x=3mol,
,解得x=3mol,

 名校课堂系列答案
名校课堂系列答案