
| A�� | X��ֵΪ1 | |
| B�� | M��ƽ����Ӧ����Ϊ0.15 mol•L-1•min-1 | |
| C�� | M��ת����Ϊ60% | |
| D�� | ƽ��ʱP��Ũ��Ϊ0.25 mol•L-1 |
���� A��5min��Ӧ�ﵽƽ�⣬������ѹǿ��С������x+2��3+1��x��2��ֻ��Ϊx=1��
B����������֮�ȵ��ڻ�ѧ������֮�ȼ���v��M����
C������W�����ʵ��������ݷ���ʽ����μӷ�Ӧ��M�����ʵ�������������M��ת���ʶ��壻
D����������֮�ȵ��ڻ�ѧ������֮�ȼ���v��P�����ٸ��ݡ�c=v��t����P��Ũ�ȣ�
��� �⣺A��5min��Ӧ�ﵽƽ�⣬������ѹǿ��С������x+2��3+1��x��2��ֻ��Ϊx=1����A��ȷ��
B������֮�ȵ��ڻ�ѧ������֮�ȣ���v��M��=1.5v��W��=0.15mol/��L•min������B��ȷ��
C��W�����ʵ���Ϊ0.1mol/��L•min����5min��2L=1mol�����ݷ���ʽ��֪�μӷ�Ӧ��M�����ʵ���Ϊ1mol��$\frac{3}{2}$=1.5mol����M��ת����Ϊ$\frac{1.5mol}{3mol}$��100%=30%����C����
D������֮�ȵ��ڻ�ѧ������֮�ȣ���v��P��=0.5v��W��=0.05mol/��L•min������P��Ũ��Ϊ0.05mol/��L•min����5min=0.25mol/L����D��ȷ��
��ѡ��C��
���� ���⿼�黯ѧƽ����йؼ��㣬�ѶȲ��������ڻ���֪ʶ�Ĺ��̣�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
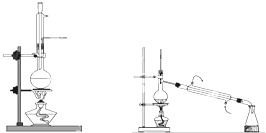 ��ʵ�黯ѧ��
��ʵ�黯ѧ��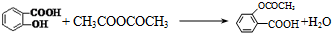
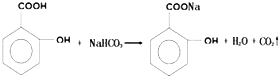 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
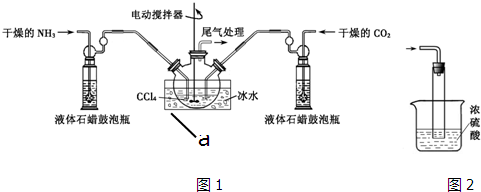
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 һѧϰС��������ͼ��ʾװ�ã���ij������Fe�ķ�ͭм����ͭ�����IJⶨ����̽���������Ʊ�����ͭ��Һ��
һѧϰС��������ͼ��ʾװ�ã���ij������Fe�ķ�ͭм����ͭ�����IJⶨ����̽���������Ʊ�����ͭ��Һ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com