
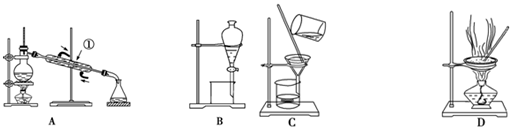
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
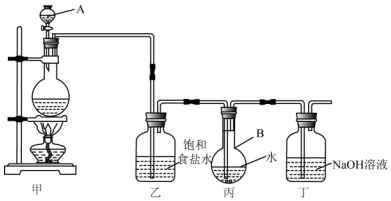
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
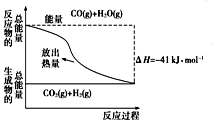
| A. | 该反应为吸热反应 | |
| B. | CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)所具有的总能量 | |
| C. | 反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=41 kJ•mol-1 | |
| D. | 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和H2O(g)要放出41 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
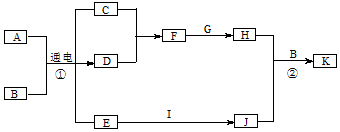
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是红棕色有刺激性气味的气体 | |
| B. | 在空气中极易被氧化生成NO2 | |
| C. | 在O2存在时能与水发生反应生成硝酸 | |
| D. | 可由NH3在催化剂作用下与O2反应生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com