
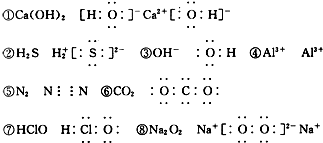
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
分析 阳离子:简单阳离子由于在形成过程中已失去最外层电子,所以其电子式就是其离子符号本身,复杂的阳离子(例如NH4+、H3O+等.) 除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.
阴离子:无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.
解答 解:①Ca(OH)2是离子化合物,由由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为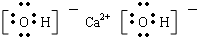 ,故正确;②硫化氢为共价化合物,不存在阴阳离子,故错误;③氢氧根是带有一个负电荷的阴离子,需要中括号,故错误;④简单阳离子的离子符号即为其电子式,故正确;⑤氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为
,故正确;②硫化氢为共价化合物,不存在阴阳离子,故错误;③氢氧根是带有一个负电荷的阴离子,需要中括号,故错误;④简单阳离子的离子符号即为其电子式,故正确;⑤氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故错误;⑥二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
,故错误;⑥二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: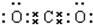 ,故错误;⑦次氯酸中O分别与H和Cl形成共价键,故错误;⑧Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为
,故错误;⑦次氯酸中O分别与H和Cl形成共价键,故错误;⑧Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故正确,故选D.
,故正确,故选D.
点评 根据原子的最外层电子数来分析电子式,并注意阴离子的电子式书写应用中括号和带电荷数,共价化合物不用中括号,将共用电子对用“-”表示即为结构式.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C7H16,主链上有2个支链的烷烃共有5种同分异构体 | |
| B. | 异丙醇与NaOH醇溶液共热生成化合物的分子式为:C3H6 | |
| C. | 甘氨酸、丙氨酸和苯丙氨酸脱水,最多可生成9种二肽 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素能形成+7价的含氧酸及其盐 | |
| B. | Y元素原子最外层电子数为2 | |
| C. | Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 | |
| D. | R元素的最高价氧化物是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
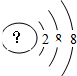 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
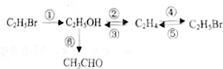
 ②CH3CH2OH
②CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O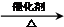 CH3CH2Br 乙醛的银镜反应
CH3CH2Br 乙醛的银镜反应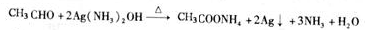
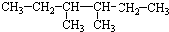 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 77 | B. | 95 | C. | 172 | D. | 249 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
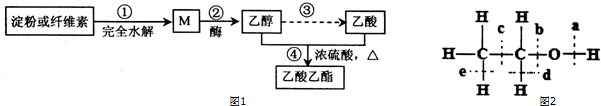
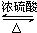 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com