
 (或是C6H5COOCH2CH3、C6H5CH2COOCH3),
(或是C6H5COOCH2CH3、C6H5CH2COOCH3), (或是C6H5COOCH2CH3、C6H5CH2COOCH3);
(或是C6H5COOCH2CH3、C6H5CH2COOCH3);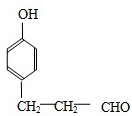 .
.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径小于或等于2.5微米(1 微米=1×10-6 米)的颗粒物,也称为“细颗粒物”,PM2.5在空气中只形成气溶胶 |
| B、核磁共振仪、红外光谱仪、紫外光谱仪、质谱仪都可用于有机化合物结构的分析 |
| C、石油裂解、煤的液化、橡胶老化、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化 |
| D、维勒打破了无机物和有机物的界限,卢瑟福提出了带核的原子结构模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应的本质是电子的转移 |
| B、在氧化还原反应中,失去电子的物质,一定有元素化合价升高 |
| C、肯定有一种元素被氧化,另一种元素被还原 |
| D、在反应中不一定所有元素的化合价都发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com