
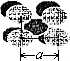
 如图,金属钨晶体的密堆结构模型图.从金属钨晶体中划分出的一个晶胞(在晶体中,仍保持一定几何形状的最小单位,又称为单元晶胞),它是一个立方体,立方体中每个角各有一个钨原子,中心有一个钨原子.假定金属钨为等径的钨原子钢性球,采取上述方法密堆积.试回答下列问题:
如图,金属钨晶体的密堆结构模型图.从金属钨晶体中划分出的一个晶胞(在晶体中,仍保持一定几何形状的最小单位,又称为单元晶胞),它是一个立方体,立方体中每个角各有一个钨原子,中心有一个钨原子.假定金属钨为等径的钨原子钢性球,采取上述方法密堆积.试回答下列问题:| 1 |
| 8 |
| 1 |
| 8 |
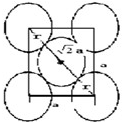 可知,图为体心立方结构,a2+(
可知,图为体心立方结构,a2+(| 2 |
4
| ||
| 3 |
| 晶胞所含原子体积 |
| 晶胞体积 |
2×
| ||
| a3 |


科目:高中化学 来源: 题型:
| A、利用灼烧法区别羊毛织物和棉织物 |
| B、热水瓶胆内的水垢[主要成分CaCO3、Mg(OH)2]用食醋清洗 |
| C、将动物油(如牛油等)与食盐溶液共热以制造肥皂 |
| D、用水果(如葡萄等)自制甜酒酿 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M |
| B、M2+ |
| C、M3+ |
| D、MO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大O2的浓度,SO3的化学反应速率减慢 |
| B、1molSO2与过量的O2反应,一定生成1molSO3 |
| C、起始投入2molSO2、1molO2与起始投入2molSO3,达到平衡状态时,SO3的体积分数相等 |
| D、往平衡体系中充入一定量的N2,使体系的压强增大,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
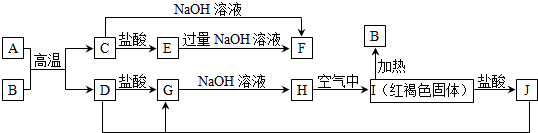
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、俗名是苏打 |
| B、相同温度下溶解度比Na2CO3大 |
| C、热稳定性比Na2CO3好 |
| D、能与酸反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、密闭、低温是存放氨水的必要条件 |
| B、实验室常用排饱和食盐水法收集氯气 |
| C、增大压强,有利于SO2与O2反应生成SO3 |
| D、加催化剂,使N2和H2在一定条件下转化为NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com