
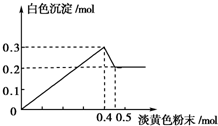
 有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如如图所示.(已知:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O).
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如如图所示.(已知:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O).分析 淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象中加入0.4mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe3+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为0.2mol,氢氧化铝为0.3mol-0.2mol=0.1mol,根据元素守恒计算Al3+、Mg2+物质的量,加入0.4mol过氧化钠之后,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,说明此时铵根完全反应,所以产生气体0.3mol即为过氧化钠与水反应生成的氧气和铵根生成的氨气,据此分析解答.
解答 解:淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象中加入0.4mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe3+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为0.2mol,氢氧化铝为0.3mol-0.2mol=0.1mol,根据元素守恒计算Al3+、Mg2+物质的量,加入0.4mol过氧化钠之后,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,说明此时铵根完全反应,所以产生气体0.3mol即为过氧化钠与水反应生成的氧气和铵根生成的氨气,
(1)由上述分析可知,淡黄色固体为:Na2O2,名称为过氧化钠,故答案为:过氧化钠;
(2)由上述分析可知,溶液中肯定有离子NH4+、Al3+、Mg2+,肯定没有Fe3+和Cu2+离子,故答案为:NH4+、Al3+、Mg2+;Fe3+和Cu2+;
(3)由纵坐标可知:n(Mg2+)=n[Mg(OH)2]=0.2mol,n(Al3+)=0.3mol-n[Mg(OH)2]=0.1mol.
当n(Na2O2)=0.4mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=0.4mol×$\frac{1}{2}$=0.2mol,所以n(NH4+)=n(NH3)=0.3mol-n(O2)=0.1mol,
故n(Mg2+):n(Al3+):n(NH4+)=0.2mol:0.1mol:0.1mol=2:1:1,
故答案为:n(Mg2+):n(Al3+):n(NH4+)=2:1:1;
(4)沉淀部分减少即为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查无机离子推断、化学图象计算等,综合性很强,根据图象结合离子反应判断含有的离子是关键,难度很大,注意开始阶段加热,会导致氨气逸出.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
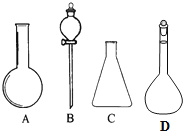 由图所示A、B、C、D四种仪器,回答下列问题.
由图所示A、B、C、D四种仪器,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子带电荷并且在一定条件下能稳定存在Ba2+,Cu2+,Ag+溶液沉淀1溶液沉淀3+C+B+A沉淀2 | |
| B. | 胶体的分散质粒子直径在1 nm~100nm之间 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚遇石蕊显红色 | B. | 食用花生油能发生水解反应 | ||
| C. | 包装用材料聚氯乙烯属于烃 | D. | PX项目中的对二甲苯属于饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 1mol/L FeCl3溶液 | B. | 50mL 0.3mol/L NaCl溶液 | ||
| C. | 10mL 0.2mol/L CaCl2溶液 | D. | 200mL 0.1mol/L NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当两极共产生22.4L(标准状况)气体时,生成了1mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com