
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X、Y元素的金属性:X比Y强 |
| B、一定条件下,Z单质与W的常见单质直接生成ZW |
| C、Y的最高价氧化物对应的水化物能溶于的Z最高价氧化物对应的水化物的稀溶液中 |
| D、一定条件下,W单质可以和Z氢化物反应直接生成ZW2 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、2Fe+3I2=2FeI3 |
| B、3Br2+6FeCl2=2FeBr3+4FeCl3 |
| C、Cl2+2KBr=2KCl+Br2 |
| D、2FeCl3+2KI=2FeCl2+2KCl+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、苯分子的比例模型: |
B、CO2的电子式: |
C、Cl-离子的结构示意图: |
| D、乙烯的结构式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏 |
| B、用氢氧化钠溶液洗涤 |
| C、用四氯化碳萃取 |
| D、用亚硫酸钠溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标有“+”的接线柱,充电时作阳极,放电时作负极 |
| B、放电时PbO2作正极,电池工作一段时间后电解质溶液密度会减少 |
| C、充电时电路中通过0.1mol电子时,电解质溶液有0.2mol H2SO4产生 |
| D、充电时阳极中PbSO4被还原为PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、红磷和白磷互称同位素 |
| B、相同量的白磷比红磷的总能量低 |
| C、该反应是吸热反应 |
| D、红磷比白磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2溶于水能部分电离,故CO2属于弱电解质 |
| B、溶于水后能电离出氢离子的化合物都是酸 |
| C、硫酸钡难溶于水,但硫酸钡属强电解质 |
| D、强电解质溶液的导电性比弱电解质溶液的导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
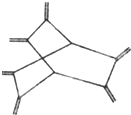
| A、豪猪烯与乙烯互为同系物 |
| B、豪猪烯分子中所有原子在同一平面 |
| C、豪猪烯的分子式为:C14H20 |
| D、豪猪烯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
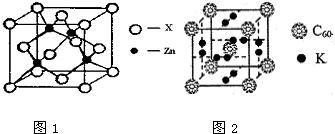 [化学-选修3:物质结构与性质]
[化学-选修3:物质结构与性质]查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com