
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
分析 Ⅰ.(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金;
(2)根据铝与NaOH溶液反应的性质设计实验方案;
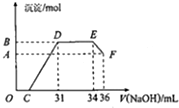
Ⅱ.(1)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应;根据题意熔融物与稀硝酸反应产生了硝酸铵,D与E一段沉淀的量没有发生变化,为NH4NO3和NaOH反应;
(2)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,利用电子守恒及发生的化学反应来计算.
解答 解:Ⅰ.(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,所以铝热反应所得到的熔融物应是铁铝合金,
故答案为:合理;
(2)铝与NaOH溶液反应生成气体,反应的化学方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,所以可用NaOH溶液检验所得的块状熔融物中含有金属铝,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
Ⅱ.(1)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O;根据题意熔融物与稀硝酸反应产生了硝酸铵,D与E一段沉淀的量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为NH4++OH-═NH3•H2O,
故答案为:H++OH-═H2O;NH4++OH-═NH3•H2O;
(2)由图可知,EF段消耗的氢氧化钠溶液为36mL-34m=2mL,则参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol,金属混合物中含有铝0.008mol,即为B、A的差值,
设铁为xmol,Al为0.008mol,生成硝酸铵为:(34-31)×0.001L×4mol/L=0.012mol,由于硝酸过量,铁反应生成了硝酸铁,由电子守恒可知,3x+0.008×3=0.012×8,解得x=0.024mol,即反应生成氢氧化铁的物质的量为0.024mol,生成沉淀的总物质的量为:0.008mol+0.024mol=0.032mol;滴加NaOH体积为31ml时,发生反应为①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,
则C点氢氧化钠溶液的体积为31mL-$\frac{0.024mol×3}{4mol/L}$×1000mL-$\frac{0.008mol×3}{4mol/L}$×1000L=7mL,
故答案为:0.008;0.032;7.
点评 本题考查较为综合,涉及铝热反应,金属与硝酸的反应、离子方程式的书写、氧化还原反应、化学计算等知识点,属于中等难度试题;解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 同系物符合同一通式 | B. | 同分异构体具有相同的分子式 | ||
| C. | 同分异构体的化学性质基本相同 | D. | 同系物的化学性质基本相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 0.1 mol•L-1 NaHCO3溶液:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-) | |
| C. | 0.1 mol•L-1Na2S溶液:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | pH=12的NaOH溶液与等体积pH=2的醋酸混合后的溶液:c (CH3COO-)+c (OH-)=c (Na+)+c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.42g Na2SO4含有的Na+离子数为0.01 NA | |
| C. | 通常状况下,NA个CO2分子含有原子数为3 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橙花醛能够发生氧化反应,不能发生还原反应 | |
| B. | 橙花醛可以使溴水褪色 | |
| C. | 橙花醛是丙烯醛是同系物 | |
| D. | 橙花醛与分子式为C10H20O的酮互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
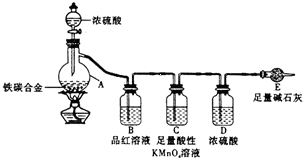 某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com