
 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5-3 | +7-1 | +6-2 | +3 |
 .
.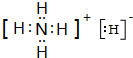 .
.分析 五种短周期元素,Y有+7、-1价,则Y为Cl,Z有+6、-2价,则Z为S元素;X有+5、-3价,处于ⅤA族,原子半径小于Cl,故X为N元素;W有最高正价+3,处于ⅢA族,原子半径大于Cl,故W为Al;T有最高正价+1,处于ⅠA族,原子半径小于N,故T为H元素.
(1)S2-离子核外电子数为18,根据核外电子排布规律画出离子结构示意图;
(2)a.电子层结构相同,核电荷数越大离子半径越小;
b.非金属性越强,对应氢化物越稳定;
c.非金属性越强,最高价氧化物对应的水化物的酸性越强;
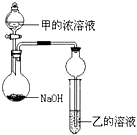
(3)甲是由T、X两种元素形成的10e-分子,则甲为NH3,乙是由Y、W两种元素形成的化合物,乙为AlCl3,将氨水浓溶液逐滴加入到NaOH固体中,氢氧化钠遇水放热,增大了OH-离子的浓度,有利于氨气的逸出,试管中生成氢氧化铝沉淀;
(4)T、X两种元素形成NH5中所有原子的最外层都符合相应稀有气体原子的最外层结构,该化合物为NH4H,由铵根离子与氢负离子构成;
(5)由氧化还原反应中得失电子守恒计算;
(6)S2Cl2分子结构与双氧水分子相似,S原子之间形成1对共用电子对,S原子与氯原子之间形成1对共用电子对.
解答 解:五种短周期元素,Y有+7、-1价,则Y为Cl,Z有+6、-2价,则Z为S元素;X有+5、-3价,处于ⅤA族,原子半径小于Cl,故Y为N元素;W有最高正价+3,处于ⅢA族,原子半径大于Cl,故W为Al;T有最高正价+1,处于ⅠA族,原子半径小于N,故T为H元素,
(1)S2-离子的结构示意图为 ,故答案为:
,故答案为: ;
;
(2)a.电子层结构相同,核电荷数越大离子半径越小,故离子半径Z(S2-)>Y(Cl-),故a错误;
b.因为Cl比S元素的非金属性强,故HCl比H2S稳定性强,故b正确;
c.因为Cl比S元素的非金属性强,故最高价氧化物对应的水化物的酸性:高氯酸>硫酸,故c错误;
故选:b;
(3)甲是由T、X两种元素形成的10e-分子,则甲为NH3,乙是由Y、W两种元素形成的化合物,乙为AlCl3,将氨水浓溶液逐滴加入到NaOH固体中,氢氧化钠遇水放热,增大了OH-离子的浓度,有利于氨气的逸出,烧瓶中即有氨气放出,一段时间后,试管中发生反应:3NH3.H2O+Al3+=Al(OH)3↓+3NH4+,生成氢氧化铝沉淀,即有白色沉淀生成,
故答案为:氢氧化钠遇水放热,增大了OH-离子的浓度,有利于氨气的逸出;白色沉淀生成;3NH3.H2O+Al3+=Al(OH)3↓+3NH4+;
(4)T、X两种元素形成NH5固体,它的所有原子的最外层都符合相应稀有气体原子的最外层结构,该化合物为NH4H,电子式为: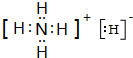 ,
,
故答案为: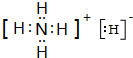 ;
;
(5)由2NO2+2NaOH=M+NaNO3+H2O可知,NO2中N元素的化合价+4价,NaNO3中N元素的化合价为+5价,由氧化还原反应中得失电子守恒可知M中N元素的化合价为+3价,
故答案为:+3;
(6)S2Cl2分子结构与双氧水分子相似,则其结构式为Cl-S-S-Cl,
故答案为:Cl-S-S-Cl.
点评 本题考查物质结构性质相互关系及应用,为高频考点,涉及物质结构判断、氧化还原反应、电子式的书写、元素周期律等知识点,明确元素周期表结构、原子结构、物质结构及元素化合物性质是解本题关键,注意知识迁移方法的应用,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为11NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
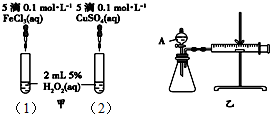 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A. | 实验中H2O2分解的速率为(1)>(2) | |
| B. | 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率 | |
| C. | H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0 | |
| D. | 图甲中(1)、(2)两个实验中H2O2分解的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
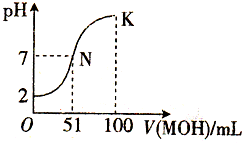 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )| A. | MA溶液的pH>7 | B. | K点时加水稀释溶液,c(H+)减小 | ||
| C. | 在N点,c(A-)=c(M+)+c(MOH) | D. | 在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com