
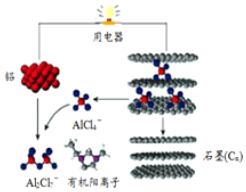
 一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )| A. | 该电池充电时的电子流向为:铝→用电器→石墨(C) | |
| B. | 该电池放电时石墨电极发生氧化反应 | |
| C. | 充电时的阴极反应为:4Al2Cl7-+3e-═Al+7AlCl4- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
分析 由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,电解时阳极发生氧化反应,电解方程式为Cn+AlCl4--e-═Cn[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,以此解答该题.
解答 解:A、该电池充电时是电解池,而放电是原电池,所以放电时电子流向为:铝→用电器→石墨(C),故A错误;
B、该电池放电时石墨是正极,电极发生还原反应,故B错误;
C、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,所以充电时的阴极反应为:4Al2Cl7-+3e-═Al+7AlCl4-,故C正确;
D、原电池中阳离子向正极移动,所以有机阳离子向石墨电极方向移动,故D错误.
故选C.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,为高频考点,侧重学生的分析能力的考查,属于综合知识的考查,难度中等,注意把握电极的判断方法和电极方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1与0.2mol•L-1醋酸溶液,c(H+)之比 | |
| B. | 0.1mol•L-1Na2HPO4溶液,c(HPO42-)与c(Na+)之比 | |
| C. | pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 | |
| D. | pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
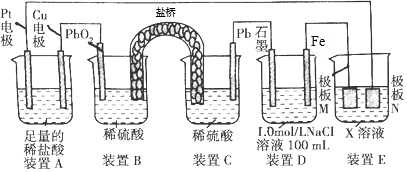
| A. | 装置B中PbO2上发生的电极反应方程式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 装置A中总反应的离子方程式为:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ | |
| C. | 若装置E的目的是在Cu材料上镀银,则极板N的材料为Cu | |
| D. | 若在装置D中生成0.2molFe(OH)3,则消耗水的物质的量共为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | 都错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HBr $\stackrel{催化剂}{→}$CH3CH2Br | |
| B. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5 | |
| C. | 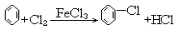 | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y的转化率相等 | |
| B. | 在恒温恒压条件下,达到平衡后充入Y气体,则平衡正向移动 | |
| C. | 平衡时,Y和Z的生成速率之比为2:3 | |
| D. | c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com