
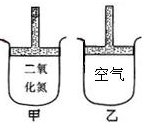
 常温常压下在带有可移动活塞的甲、乙容器(如图)里分別充有二氧化氮和空气.现分別进行下列两个实验:
常温常压下在带有可移动活塞的甲、乙容器(如图)里分別充有二氧化氮和空气.现分別进行下列两个实验:| A、①甲>乙 ②甲>乙 |
| B、①甲>乙 ②甲<乙 |
| C、①甲<乙 ②甲<乙 |
| D、①甲>乙 ②甲=乙 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、MgCl2(熔融)
| ||||
B、2AlCl3(熔融)
| ||||
C、HgO+CO
| ||||
D、2MgO+C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:B<E |
| B、最高价氧化物对应的水化物碱性:C<D |
| C、简单离子半径:E<D |
| D、均含有A,B,C,E四种元素形成的两种化合物可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铅有+2和+4两种价态,铅的常见氧化物四氧化三铅(Pb2O4)和二氧化铅(PbO2)均常用于蓄电池中,回答下列问题:
铅有+2和+4两种价态,铅的常见氧化物四氧化三铅(Pb2O4)和二氧化铅(PbO2)均常用于蓄电池中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B、用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
| C、氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ |
| D、0.01 mol?L-1NH4Al(SO4)2溶液与0.02 mol?L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com