
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2NH3(g)N2(g)+3H2(g) ΔH=+92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质 物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量a kJ |
| ② | 0 | 1 | 3 | 放出热量b kJ |
| ③ | 4 | 0 | 0 | 吸收热量c kJ |
下列叙述正确的是( )
A.热量关系:a=b
B.①②③反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
解析:本题考查了化学平衡知识,意在考查考生对平衡常数、体积分数以及平衡状态的理解和计算能力。若反应①中NH3的平衡转化率为50%,则a=b,若反应①中NH3的平衡转化率小于50%,则a<b,若反应①中NH3的平衡转化率大于50%,则a>b,A选项错误;温度相同,所以反应①、②、③的平衡常数相同,B选项错误;反应③可以看成是在两个相同容器中相同条件下同时进行反应①,达平衡后,把这两个容器中的气体压缩到其中一个容器中,如果平衡不移动,氢气的体积分数应该与反应①相等,但是压强增大,平衡向逆反应方向移动,氢气的体积分数减小,所以达平衡时氢气的体积分数:①>③,C选项正确;因为气体总质量始终不变,容器恒容,所以密度始终不变,不能用密度变化来衡量反应是否达到平衡,D选项错误。
答案:C


科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和
H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
其它条件不变,只降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
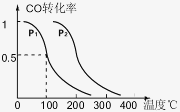 (2)反应室3(容积可变的密闭容器)中 0.2molCO与
(2)反应室3(容积可变的密闭容器)中 0.2molCO与
0.4molH2在催化剂作用下发生可逆反应生成甲醇:
CO(g)+2H2(g) CH3OH(g),CO的平衡转化率
CH3OH(g),CO的平衡转化率
与温度、压强的关系如右图所示,则:
①P1 P2 (填“<”、“>”或“=”)。
②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时 若温度不变,再加入1.0molCO后重新达到平衡,CO的平衡转化率 (填“增大”、“不变”或“减小”)。
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2molCO与0.4molH2, CO的平衡转化率 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法正确的是( )
A.乙烯、甲苯、甲烷分子中的所有原子都在同一平面上
B.除去乙烷中的乙烯时,通入氢气并加催化剂加热
C.C3H8的二氯代物共有3种
D.用新制氢氧化铜可以鉴别乙酸、葡萄糖两种溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
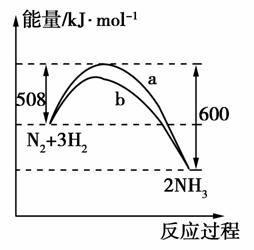
A.该反应的热化学方程式为:2NH3N2+3H2 ΔH=-92 kJ·mol-1
B.正反应的活化能小于逆反应的活化能
C.a曲线是加入催化剂时的能量变化曲线
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.某兴趣小组用如图装置做了两次实验。
实验①:向甲池的Pt电极表面通氢气,发现电流计指针发生了偏转,乙池的Pt电极表面出现气泡。
实验②:向乙池的Pt电极表面通氧气,发现电流计指针也发生了偏转,且偏转方向与实验①相同,同时甲池的Pt电极表面也出现气泡。
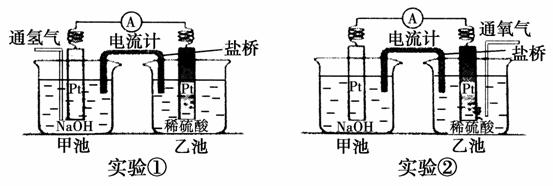
(1)实验①,甲池通氢气的Pt电极为________________极,电极反应式为_________________________________________________。
(2)实验②,乙池通氧气的Pt电极为________________极,电极反应式为__________________________________________________。
(3)两次实验中原电池的总反应相同,总反应的离子方程式为___
__________________________________________________________。

Ⅱ.电解法污水处理技术已很成熟。富含悬浮物的工业污水采用如图装置进行处理:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,吸附部分悬浮物沉降,同时阴极产生的气泡将部分悬浮物带到水面形成浮渣层,然后滤去沉淀、撇掉浮渣层。富含有机废物的生活污水也可用同样方法进行处理。污水中的有机废物能被阳极的某一产物迅速降解成二氧化碳、水等无机物。
(1)在电解处理过程中,若污水中离子浓度较小,导电能力较差,处理效率下降,此时可向污水中加入适量的________。
a.BaSO4 b.CH3COOH
c.NaNO3 d.CH3OH
(2)电解处理过程中,阳极实际发生了两个电极反应,阳极的电极反应式分别是①________________;②________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,1 mol X和n mol Y在体积为2 L的密闭容器中发生如下反应:X(g)+Y(g)2Z(g)+M(s),5 min后达到平衡,此时生成2a mol Z。下列说法正确的是( )
A.用X表示5 min内此反应的反应速率是(0.1-0.2a) mol·(L·min)-1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入1 mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入1 mol X,v(正)增大,v(逆)减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的A(g)与B(g)在密闭容器中进行反应:A(g)+B(g)2C(g)+D(s) ΔH<0,下列叙述正确的是( )
A.达到平衡后,反应速率v正(A)=2v逆(C)
B.达到平衡后,增大压强,平衡逆向移动
C.达到平衡后,升高温度,平衡正向移动
D.平衡常数K值越大,A的转化率越高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO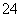 、NO
、NO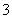
B.可用稀硝酸除去试管内壁上的银镜
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO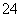
D.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.Cu(OH)2中加入硫酸:OH-+H+===H2O
B.钠加入水中:Na+2H2O===Na++2OH-+H2↑
C. FeSO2溶液中加入稀硝酸:3Fe2++4H++NO ===3Fe3++2H2O+NO↑
===3Fe3++2H2O+NO↑
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com