
 氨的催化氧化是工业制硝酸的重要反应,500°C,其反应方程式为:
氨的催化氧化是工业制硝酸的重要反应,500°C,其反应方程式为: ;
;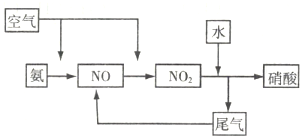 ,故答案为:
,故答案为: ;
; ;N 3-离子核外电子数为10,能够形成10电子离子的原子有 Na、Mg、Al、O、F,据已知的电子层数和质子数判断原子半径大小,电子层数越多,原子半径越大,相同电子层时,质子数越多,原子半径越小,Na>Mg>Al>O>F;元素的非金属性越强,其对应氢化物越稳定,N、O、F非金属性依次增强,所以其氢化物稳定性HF>H2O>NH3
;N 3-离子核外电子数为10,能够形成10电子离子的原子有 Na、Mg、Al、O、F,据已知的电子层数和质子数判断原子半径大小,电子层数越多,原子半径越大,相同电子层时,质子数越多,原子半径越小,Na>Mg>Al>O>F;元素的非金属性越强,其对应氢化物越稳定,N、O、F非金属性依次增强,所以其氢化物稳定性HF>H2O>NH3 ; Na>Mg>Al>O>F;HF>H2O>NH3;
; Na>Mg>Al>O>F;HF>H2O>NH3; ;氨被双氧水氧化为游离态氮,每mol氨失3mol电子,H2O2得电子生成H2O,每mol得2mol电子,所以氨分子和过氧化氢分子化学计量数之比为2:3,再据原子守恒书写化学方程式为:2NH3+3H2O2=N2+6H2O,
;氨被双氧水氧化为游离态氮,每mol氨失3mol电子,H2O2得电子生成H2O,每mol得2mol电子,所以氨分子和过氧化氢分子化学计量数之比为2:3,再据原子守恒书写化学方程式为:2NH3+3H2O2=N2+6H2O, ;2NH3+3H2O2=N2+6H2O.
;2NH3+3H2O2=N2+6H2O.


科目:高中化学 来源: 题型:
| A、加入适量的NaCl,可使c(NH4+)=c(Cl-) | ||||
| B、滴加几滴浓氨水,c(NH4+)减小 | ||||
C、滴加几滴浓盐酸,
| ||||
| D、1.0 mol?L-1的NH4Cl溶液中c(NH4+)比该混合溶液大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离出的c(OH-)=0.001mol/L的溶液:H+、Fe 2+、Cl-、SO4 2- |
| B、c(H+)=0.001mol/L的溶液:NH4+、Ba 2+、A1O2-、Cl- |
| C、pH=12的溶液:K +、Fe 2+、ClO-、Br- |
| D、与铝反应产生大量氢气的溶液:Na+、NH4+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑥ | B、①②③⑥ |
| C、①②⑥ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| B、用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA |
| C、已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA |
| D、142g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制取蒸馏水的装置中冷水从冷凝管的上口进,下口出 |
| B、任何可燃性气体点燃前都必须检验纯度 |
| C、NaCl溶液蒸发结晶时,蒸发皿中刚有晶体析出即停止加热 |
| D、氢氧化铁胶体中滴加少量稀硫酸,因发生化学反应而沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com