
分析 (1)该反应中元素的化合价变化如下:2KI→I2,I元素的化合价由-1价→0价,I失去2e-;NaNO2→NO,N元素的化合价由+3价→+2价,得到e-,根据氧化还原反应中得失电子数相等和原子守恒进行配平;根据反应2KI→I2,I元素的化合价由-1价→0价,价态升高的元素只有I,生成1mol碘单质转移电子数为2mol计算;
(2)①NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,反应生成硫酸钡、硫酸钠和水;
②向Ba(OH)2溶液中逐滴加入NaHSO4溶液至恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水;
(3)因为氧化性Cl2>Br2>Fe3+,所以还原性Fe2+>Br->Cl-,则向FeBr2溶液中通入Cl2时,氯气先氧化Fe2+后氧化Br-,如果溶液中有一半的Br-被氧化,则亚铁离子完全被氧化,据此书写;
(4)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,反应生成硫酸钠、氯化钠,据此配平书写离子方程式.
解答 解:(1)该反应中元素的化合价变化如下:2KI→I2,I元素的化合价由-1价→0价,I失去2e-;NaNO2→NO,N元素的化合价由+3价→+2价,得到e-,化合价升高数=化合价降低数,所以得失电子的最小公倍数为2,所以NaNO2前的系数是2,I2前的系数是1,根据钠、钾原子守恒,K2SO4前是1,Na2SO4前是1,根据硫酸根守恒,反应物少2个H2SO4分子,据氧原子和氢原子守恒,产物水前的系数为2,所以该反应为:2NaNO2+2KI+2H2SO4═2NO↑+I2+K2SO4+Na2SO4+2H2O;
根据2KI→I2,每生成1molI2,转移2mol电子,50.8g碘单质的物质的量n=$\frac{m}{M}$=$\frac{50.8g}{254g/mol}$=0.2mol,所以转移电子数=nNA=0.2×2NA=0.4NA;
故答案为:2;2;2H2SO4;2;1;1;1;2H2O;0.4NA;
(2)①NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,反应生成硫酸钡、硫酸钠和水,离子方程式为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
故答案为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
②向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水,离子方程式为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;故答案为:H++SO42-+OH-+Ba2+=BaSO4↓+H2O;
(3)向FeBr2溶液中通入Cl2时,根据氧化性Cl2>Br2>Fe3+,所以还原性Fe2+>Br->Cl-知,氯气先氧化Fe2+后氧化Br-,如果溶液中有一半的Br-被氧化,则亚铁离子完全被氧化,所以反应离子方程式为2Cl2+2Br-+2Fe2+=4Cl-+2Fe3++Br2,
故答案为:2Cl2+2Br-+2Fe2+=4Cl-+2Fe3++Br2;
(4)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,配平后的离子方程式为:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+,
故答案为:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
点评 本题考查了氧化还原反应的配平及其离子方程式的书写,明确化学反应的实质、掌握离子方程式书写的方法是解题关键,注意反应物用量对反应的影响,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
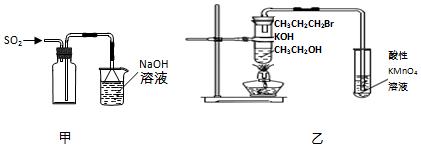
| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 样本质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.19 | 11.82 | 17.73 | 23.64 | 23.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成Cu的物质的量是0.2mol | B. | 转移电子的物质的量是0.4mol | ||
| C. | 随着电解的进行溶液的pH减小 | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2+SO42-;氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 硝酸银与氯化氢溶液反应:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 碳酸氢钠溶液与稀硫酸溶液混合:HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]•3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4•2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com