
| A. | 常温下,1.0 L 1.0 mol•L-1KAlO2溶液中含有的氧原子数为2 NA | |
| B. | 7.8 g Na2O2固体中含有的阴离子数为0.2 NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.1 mol Cl2参加氧化还原反应,转移的电子数目一定是0.2 NA |
分析 A、KAlO2溶液中,除了偏铝酸钠外,水也含氧原子;
B、求出过氧化钠的物质的量,然后根据过氧化钠由2个阳离子和1个阴离子构成来分析;
C、求出混合气体的物质的量,然后根据二氧化碳和二氧化硫均含2个氧原子来分析;
D、氯气反应后的价态不明确.
解答 解:A、KAlO2溶液中,除了偏铝酸钠外,水也含氧原子,故溶液中的氧原子的个数多于2NA个,故A错误;
B、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个阳离子和1个阴离子构成,故0.1mol过氧化钠中含0.1NA个阴离子,故B错误;
C、标况下2.24L混合气体的物质的量为0.1mol,而二氧化碳和二氧化硫均含2个氧原子,故0.1mol混合物中含0.2NA个氧原子,故C正确;
D、氯气反应后的价态不明确,故0.1mol氯气反应后转移的电子数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:解答题
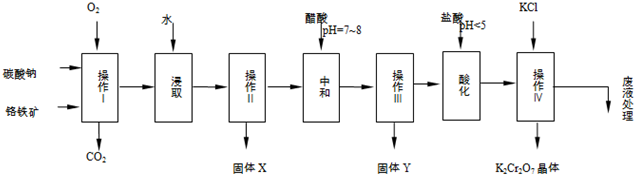
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
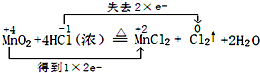 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡跟硫酸铜溶液的反应:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| B. | 石灰石溶于稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 少量的氢氧化钡与硫酸氢钠溶液混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
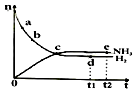 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:| A. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| B. | 点c处反应达到平衡 | |
| C. | 点a的正反应速率比点b的大 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
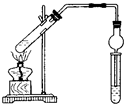 用图所示实验装置制取乙酸乙酯.回答以下问题:
用图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com