

 CO↑+H2O(2)样品由黑色变红色;CO、CO2(3)cab(4)80%(5)将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;CuO+H2SO4=CuSO4+H2O
CO↑+H2O(2)样品由黑色变红色;CO、CO2(3)cab(4)80%(5)将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;CuO+H2SO4=CuSO4+H2O Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2; CO↑+H2O;
CO↑+H2O; CO↑+H2O;
CO↑+H2O; Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2; Cu+CO2,固体质量减少△m
Cu+CO2,固体质量减少△m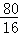 ×0.2g=1g,
×0.2g=1g,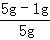 ×100%=80%;
×100%=80%;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:问答题
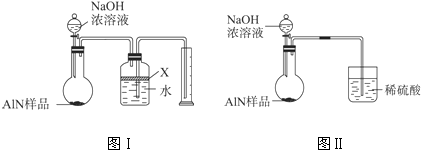
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
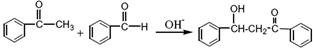
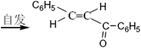 (查尔酮)
(查尔酮)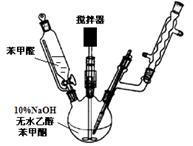
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
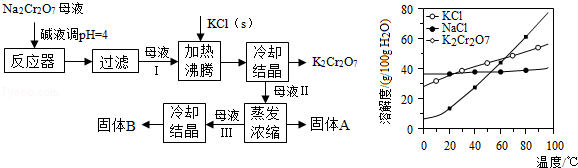
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体, 具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
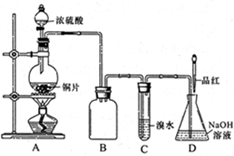
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | | III |
| ② | 滴加少量棕红色的KI3溶液,振荡 | | II |
| ③ | 滴入加少量酸性KMNO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
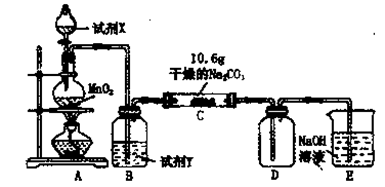
 (3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com