
A.电池负极(锌筒)的电极反应式为:Zn-2e-====Zn2+
B.电池正极(石墨)的电极反应式为:2MnO2+2![]() +2e-====Mn2O3+2NH3+H2O
+2e-====Mn2O3+2NH3+H2O
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
 (1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g)?2B(g) 2B(g)?2D(g)+C(g)测得平衡时各物质的浓度是:c(A)=0.3mol?L-1,c(B)=0.2mol?L-1,c(C)=0.05mol?L-1,则最初加入的A物质的量是
(1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g)?2B(g) 2B(g)?2D(g)+C(g)测得平衡时各物质的浓度是:c(A)=0.3mol?L-1,c(B)=0.2mol?L-1,c(C)=0.05mol?L-1,则最初加入的A物质的量是查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
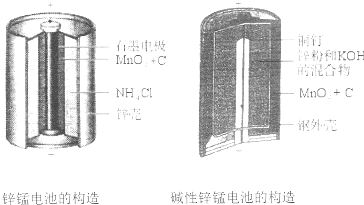
锌一锰干电池的总反应式为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,下列说法
错误的是
A.电池负极(锌筒)的电极反应式为:Zn-2e-=Zn2+
B.电池正极(石墨)的电极反应式为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com