
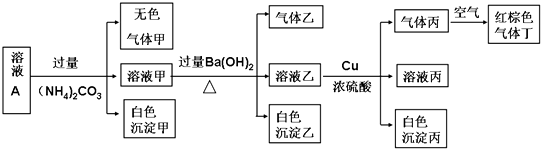
| A、沉淀乙一定有BaCO3,可能有BaSO4 |
| B、实验消耗Cu 14.4g,则生成气体丁的体积为3.36L |
| C、该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 |
| D、生成的甲、乙、丙气体均为无色的易溶于水气体 |
| 14.4g |
| 64g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
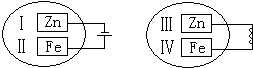 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,观察到的现象和对应方程式都正确的是( )
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,观察到的现象和对应方程式都正确的是( )| A、Ⅰ附近溶液变红,Zn-2e-=Zn2+ |
| B、Ⅳ附近溶液变红,O2+2H2O+4e-=4OH- |
| C、Ⅱ附近有黄绿色气体生成,2Cl--2e-=Cl2↑ |
| D、Ⅲ附近有无色气体生成,2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
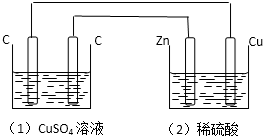 如图装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线上通过了0.02mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )
如图装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线上通过了0.02mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )| A、(1)、(2)两装置均为电解池 |
| B、(1)、(2)溶液的PH均减小 |
| C、(1)中阳极电极反应式为:4OH--4e-═2H2O+O2↑ |
| D、(1)中阴极上析出0.32 g Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
 探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.
探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M>N | B、M<N |
| C、M=N | D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,SO2的浓度与SO3的浓度相等 |
| B、相同状况下,反应2SO3(g)?2SO2(g)+O2(g)是一个吸热反应 |
| C、在密闭容器中加入2molSO2和1molO2充分反应后放出197KJ的热量 |
| D、升高温度,吸热反应的速率增大,放热反应的速率减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40mL | B、72mL |
| C、80mL | D、128mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com